Az amerikai Élelmiszer- és Gyógyszerügyi Hivatal (FDA) vakcinák és kapcsolódó biológiai termékek tanácsadó bizottsága legutóbb, 2022. április 6-án azért ült össze, hogy megvitassa a COVID19 emlékeztető oltások használatával kapcsolatos megfontolásokat, valamint a COVID-19 vakcinatörzs kiválasztási folyamatát a jelenlegi és a kialakulóban lévő vírusváltozatok kezelése érdekében.
Dr. Peter Doshi pedig bejelentkezett erre a nyilvános meghallgatásra. Ez egy olyan alkalom, amikor a nagyközönség az FDA-nak elmondhatja az általa összegyűjtött információkat.
Dr. Doshi a University of Maryland School of Pharmacy gyógyszerészeti karának docense, valamint a British Medical Journal vezető szerkesztője. "Kutatásainak középpontjában a gyógyszerek engedélyezési folyamata, az egészségügyi termékek kockázatairól és előnyeiről szóló kommunikáció, valamint a tudományos bizonyítékok szintézisének és az orvosi-biológiai publikációk hitelességének és pontosságának javítása áll."
Ez a hírlevél részben Naked Emperor bejegyzése alapján készült - a fenti videón pedig az FDA ülésérők Peter Doshi felszólalása látható, hallható.
Peter Doshi hiteles embernek tűnik, és olyan kérdésekről is beszámol, amelyekről a legtöbb főáramú kiadvány nem ír, illetve nem akar beszámolni. Már osztottam meg olyan videót, amin ő beszél, itt láthatjátok:
A megosztott videó tartalma, röviden:
Peter beszámolt az FDA-nak Brook Jacksonról, aki a Pfizer vakcinakísérleteit vezető Ventavia egyik munkavűállalója volt. Brook Jakson arról számlt be, hogy a jelek szerint feloldották a vizsgálatban résztvevők vakságát (ez azt jelenti, hogy tájékoztatták őket arról, hogy a placebó-, vagy a kísérleti készítményt kapott csoportban vannak-e), ez pedig komoly aggályokat vet fel az adatok integritásával kapcsolatban. Dr. Doshi azt is kiemelte, hogy az FDA nem ellenőrizte a vizsgálatokat. Az alábbiakban olvasható a hozzászólás átirata.
Üdvözletem, Peter Doshi vagyok, és köszönöm a felszólalási lehetőséget. Remélem látható a címben szereplő dián a pénzügyi nyilatkozatom. Az azonosítás kedvéért: a Marylandi Egyetem tanára vagyok, és a BMJ szerkesztője. Nem vagyok összeférhetetlen, és a mai észrevételeim a saját véleményemet tükrözik.
Tavaly novemberben a The BMJ beszámolt azokról az információktól, amit Brook Jackson, a Pfizer vakcinájának három klinikai kísérleti központját működtető szerződéses kutatócég, a Ventavia munkatársa hozott a tudomására. Jackson azt állította, hogy a vállalat meghamisította az adatokat, nem vakította el a betegeket, nem megfelelően képzett oltóorvosokat alkalmazott, és a nemkívánatos mellékhatások utánkövetésében lassú volt.
Ezen a képen például olyan vakcinák csomagolóanyagai láthatók, amelyeket csak a nem vak személyzetnek szabadna látnia, de ezeket csak úgy kint hagyták.
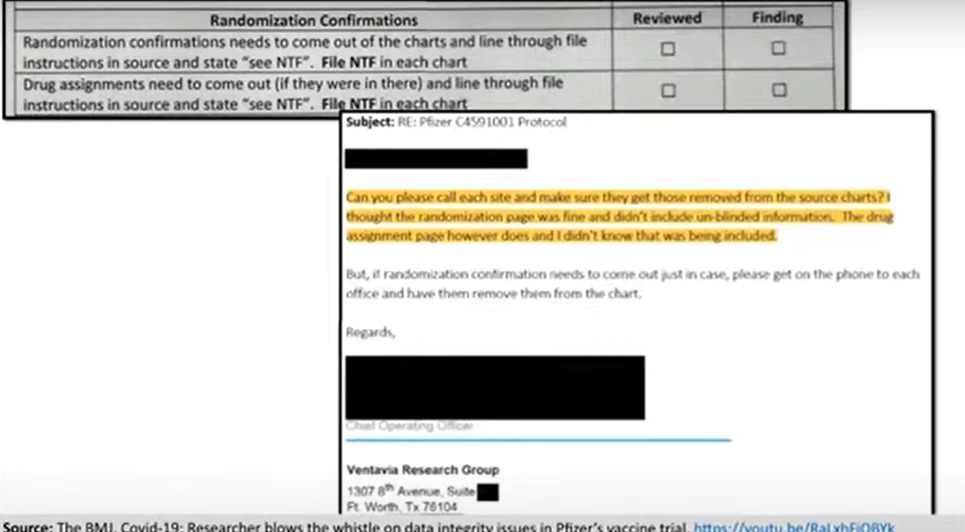
Ezenkívül jóval szélesebb körben történhetett a feloldás. Ez az irat a Ventavia munkatársainak szóló utasítás, mely szerint a vizsgálatban részt vevő minden ember randomizációs és gyógyszerkiosztási igazolásait a résztvevő személyi kartonjába kell tenni. Ebben nem vak adatok szerepelnek.
Szerintem mindenki tudja, hogy a vakítás feloldása, komoly aggályokat vet fel az adatok integritásával kapcsolatban. Amikor a hiba kiderült, a Ventavia munkatársai minden egyes kórlapot átnéztek, és kivették a randomizálási és a gyógyszerkiosztási igazolásokat. Íme a Ventavia operatív igazgatójának egy emailje, amit a probléma felfedezése után írt: észre sem vették, hogy a gyógyszerkiosztás igazolása nem vak információkat tartalmaz.
A világjárvány hevében nem nehéz elképzelni, hogy a kanyarokat levágták, és hibáztak. Vannak ártalmatlan hibák, ám egyesek jelentős hatással vannak az adatok integritására. Reméljük, a Ventavia egy extrém kivételes eset, de a reménynél többre van szükségünk. Bizonyítékra van szükségünk arról, hogy az adatokat megfelelően kezelték. Szabályozási felügyeletre van szükségünk. De annak ellenére, hogy Brook Jackson bejelentő közvetlenül panaszt tett az FDA-nál, Az FDA soha nem ellenőrizte a Ventaviát. Valójában az FDA a jóváhagyása előtt csak 9 helyszínt ellenőrzött a kísérlet több mint 150 helyszínéből. Csak 9 helyszínt. A Pfizer pedig továbbra is a Ventaviát használja kísérletekhez.
Mi a helyzet a Modernával? Az FDA-nak több mint egy éve volt, és a vizsgálat 99 helyszínéből csak egyet ellenőrzött. Hogyan bízhat az FDA egy 1%-os minta alapján a Moderna adataiban?
Az adatintegritás megfelelő szabályozási felügyeletet igényel. A megbízható tudomány megköveteli az adatok átláthatóságát. Több mint egy év telt el, de a résztvevők anonimizált adatai az orvosok, kutatók és a nyilvánosság számára hozzáférhetetlenek. A lakosság fizeti ezeket a készítményeket, és a lakosság vállalja az oltások utólagos előnyeit és ártalmait. A nyilvánosságnak joga van az adatok átláthatóságához, az FDA-nak pedig kötelessége cselekedni. Köszönöm.
A találkozóról készült videó ezen a linken látható, Doshi nyilatkozata 5:34:44-nél kezdődik.










Share this post