A tüskefehérje egy amiloid, ami lerakódik és amiloidózist okoz - oltás utáni bőrproblémák és tovább
A tüskefehérjének a szövetekben történő patológiás lerakódásáról
Javaslom, hogy mielőtt belevágsz ebbe, olvasd el, mi az az amilodiózis. Katt ide, ha érdekel.
Angolul tudóknak ez a videó különösen érdekes lehet, igyekszem feliratozni, de nem ígérek semmit, egyelőre angolul van meg. Ha esetleg törlik, kommenteljetek ide, letöltöttem, akkor adok másik linket.
Már régen unom ezt a témát, de Parsifaler tweetje mégis arra késztetett, hogy lefordítsam a lenti tanulmányt, de mielőtt belevágunk, a tweet (és fordítása a hivatkozás alatt:)



“A The histologic and molecular correlates of COVID-19 vaccine-induced changes in the skin című tanulmányban felvetették, hogy a tüskefehérjére adott immunválasz okozza az oltóanyaggal szembeni túlérzékenységi reakciókat. Ha figyelmesen elolvassuk a cikket, feltűnik az, hogy a szerzők egy ennél sokkal fontosabb dolgot figyelmen kívül hagytak.
A tanulmányban a levett szövettani mintákból megállapították, hogy az oltás után elvégzett szövettani vizsgálat szerint az elvileg egészséges emberek bőréből levett szövettani mintában, és az oltás után bőrkiütésben jelentkező mellékhatás miatt károsodott bőrből levett mintában is a bőr mélyében lévő mikroerekben a tüske glikoprotein komplement lerakódás nélküli jelenléte kimutatható volt. (Azaz a tüskefehérje mindkét esetben ott van a mikorerekben.)
A szövettan tökéletesen megfelelt a perniózisnak, beleértve a COVID-19-hez társuló perniózist is, ami azt bizonyítja, hogy a tüskefehérje önmagában kiváltja a COVID-19 patológiáját.
És ami még ennél is érdekesebb, az az, hogy a tüskefehérje az egészséges bőrben is ott volt, a mély erekben, a mikroerekben, a vérerekben és a mély endotélsejtekben lerakódva. Parsifaler jogos kérdése: “Miért feltételezzük azt, hogy ez a lerakódás csak a normál bőrszövetben fordul elő? Úgy vélem, hogy (a tüskefehérje) minden bizonnyal a többi szövetben is megjelenik. Pont.”
Lefordítottam azt a tanulmányt, amire a tweet hivatkozik. Ha a tweet szövegét szem előtt tartjátok - azaz azt, hogy a tüske feltehetőleg minden szövetben megjelenik - akkor sokkal inkább bejut az, amiről szól.
A COVID-19 vakcina által kiváltott bőrelváltozások szövettani és molekuláris elemzése
Absztrakt
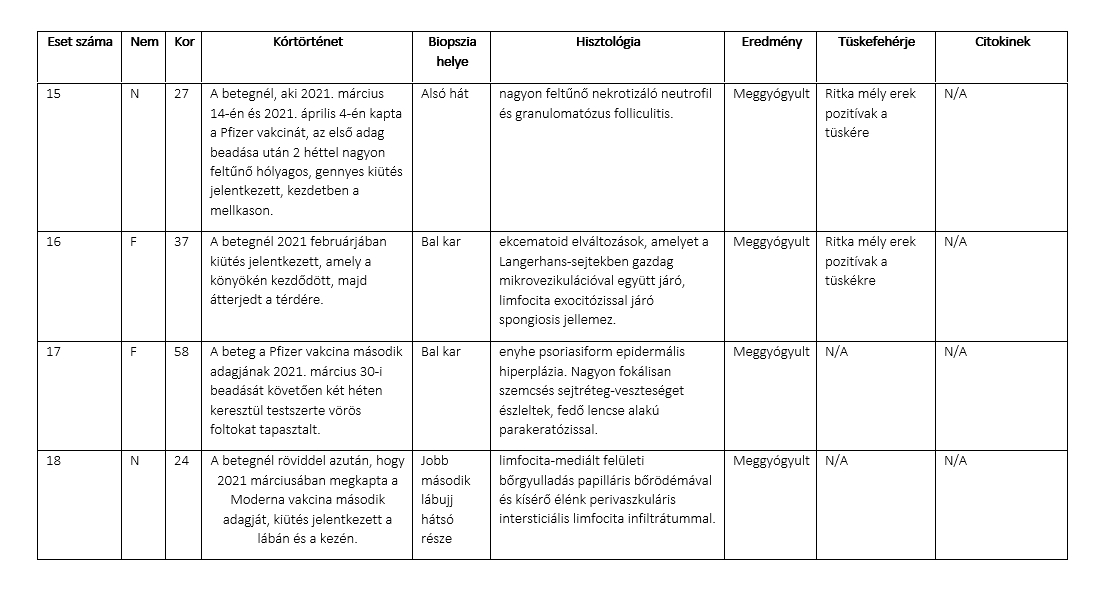
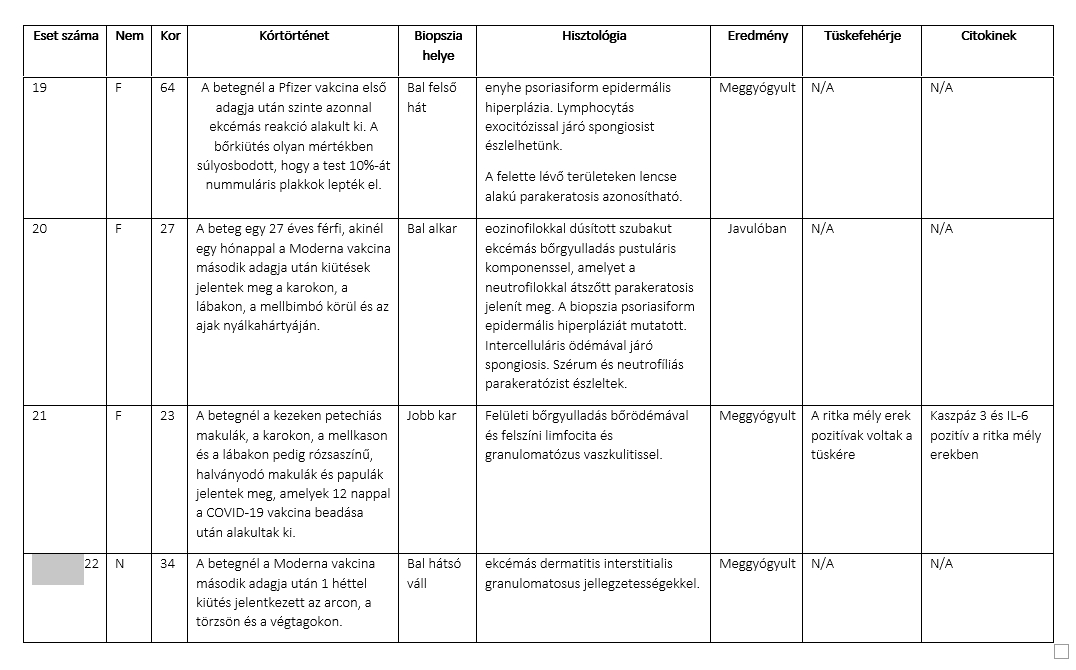
A Moderna és a Pfizer oltóanyagára mellékhatásként fellépő bőrreakciókat mutató 22 betegből vettünk biopsziát. Minden beteg esetében fénymikroszkópos vizsgálatot végeztünk, és a kiválasztott biopsziák esetében tüske glikoprotein és citokin vizsgálatra is sor került. A betegeknél a Pfizer vagy a Moderna vakcina első vagy második adagjának beadását követően 1 naptól 4 hétig terjedő átmeneti időn belül jelentkeztek önmaguktól gyógyuló bőrreakciók, amelyeket a klinikai leírás szerint általában csalánkiütéses vagy ekcémás bőrreakcióknak neveztek. A IV. típusú bőr túlérzékenység klasszikus klinikai és morfológiai képét figyelték meg, ekcémás dermatitis, interface dermatitis, granulomatosus gyulladás és/vagy limfocita vaszkulitikus komponens jellemzőivel. A kiválasztott esetekben a perniózis, a pityriasis rosea, a pityriasis rubra pilaris és a guttata psoriasis klinikai és/vagy szövettani jellegzetességei mutatkoztak. Két esetben a domináns kép urticariás vasculitis volt, ami valószínűleg Artus reakció volt. A vakcinázás utáni normál bőr és az oltás utáni bőrkiütés által érintett bőr biopsziás mintáin a tüske glikoproteinre pozitív, ritka, mély mikroerek voltak láthatóak, komplement lerakódás nélkül, ellentétben a 2019-es súlyos koronavírusos betegségben (COVID-19) szenvedő betegek bőrbiopsziáiban talált a tüskefehérje és a komplement nagyobb mértékű érrendszeri lerakódásával. Arra a következtetésre jutottunk, hogy a vakcinával szembeni önkorlátozó túlérzékenységi reakciók valószínűleg a vakcina hordozóanyagában található anyag (pl. polietilénglikol) miatt fordulnak elő. Számításba kell venni, hogy ez egy olyan immunválasz, amely az embernek a saját sejtjei által előállított tüske ellen irányul, mivel néhány reakció klinikailag és vagy szövettanilag nagyon hasonlít az enyhe COVID-19-re. Végül, a vakcinához kapcsolódó immunreakció nagyrészt a vakcina adjuváns tulajdonságainak tulajdonítható, és megmutathatja egyes olyan gyulladásos állapotok működését, mint a pikkelysömör, az atópiás dermatitisz és a szubklinikai túlérzékenység.
Bevezetés
Több mint 176 millió esetet jelentettek a 2019. évi koronavírusos megbetegedésből (COVID-19), amelynek világszerte több mint 3,8 millió halálos áldozata volt. A COVID-19 olyan világjárvány, amely mélyreható társadalmi változásokat eredményezett, ugyanakkor világszinten egységfrontot alakított ki annak érdekében, hogy véget vessen a járványnak. A számos hatékony vakcina megjelenésével a közeljövőben világméretű nyájimmunitás prognosztizálható. Minden COVID-19 vakcina működésének epicentruma a spike glikoproteinre adott immunválasz, amely protein a vírus bejutásához kötelezően szükséges angiotenzin konvertáló enzim 2-hez (ACE2) kötődő döntő fontosságú víruskapszidfehérje.1, 2, 3
A súlyos akut légzőszervi szindrómát okozó koronavírus 2 (SARS-CoV-2) elleni vakcinák nem akadályozzák meg a fertőzést. Ugyanakkor a COVID-19 súlyos formáit megelőzik azáltal, hogy hatékony T-sejt-közvetített és humorális (antitest-) mediált immunválaszt váltanak ki. Az Egyesült Államokban leggyakrabban alkalmazott két vakcina a Moderna vakcina (mRNS-1273), amely egy nukleoziddal módosított olyan hírvivő RNS, amely a SARS-CoV-2 tüskefehérjét kódolja, továbbá a Pfizer-BioNTech (BNT162b2) mRNS, amely ugyanezt a fehérjét kódolja. 1,4,5
Szintén elérhető a Johnson & Johnson vakcina (Ad26.COV2.S), amely vírusvektor alapú, és az adenovírus 26 módosított változatát használja a tüskefehérje kódolásához. A vakcinák a SARS-CoV-2 receptorkötő fehérjéjére, nevezetesen a tüske glikoproteinre összpontosítanak, a sejteket ennek az idegen fehérjének a termelésére késztetve, és ezáltal olyan immunválaszt elősegítve, amely hatékonyan megelőzi a COVID-19 okozta súlyos betegség szövődményeit. Paradox módon a tüske glikoprotein az, amely valószínűleg fontos szerepet játszik a súlyos és kritikus COVID-19 patogenezisében, és a feltételezések szerint a COVID-19 érrendszeri szövődményeinek középpontjában áll.
Korábbi tanulmányainkban kimutattuk, hogy a SARS-CoV-2 tüske glikoprotein az ACE2-n keresztül kötődik az endotheliumhoz, és komplement által közvetített mikrovaszkuláris károsodást eredményez a tüdőben és más olyan mikrovaszkuláris területeken, ahol az endothelium magas ACE2+ expresszióval rendelkezik, mint például a bőr és az agy.6 A komplementaktiváció alapja, hogy a tüske glikoprotein specifikus cukoregységekkel rendelkezik, amelyeket a mannán-kötő lektin felismer, ami a MASP-2 aktiválásához vezet, ami végül C5b-9 képződését eredményezi, ami aztán károsítja az endothelium sejtmembránjait.7
Az adatok arra utalnak, hogy a tüdőtől és az orrgarattól eltekintve más helyeken a tüske glikoprotein és az endothelium kapcsolódása intakt vírus nélkül történik, amint azt az elektronmikroszkópos vizsgálaton a vírusrészecskék hiánya és az in situ kimutatható vírus RNS hiánya mutatja.7
Hasonlóképpen, a tüskefehérje S1 alegységének (de nem az S2 alegységének) nagy dózisú injekcióját kapó egereknél a központi idegrendszer érkárosodásával összefüggő neurológiai tünetek alakultak ki; a tüskefehérje kimutatható volt a károsodott központi idegrendszeri mikroerekben.8 Így feltételezhetjük, hogy az mRNS-alapú vakcina beadását követően a miociták által szintetizált tüske glikoprotein szétterjedhet bizonyos ACE2+ mikroerekbe. Figyelembe véve az eddig mellékhatás nélkül beoltott emberek millióit, ennek a mikrovaszkuláris disszeminációnak az esetleges előfordulása klinikailag nem tűnik jelentős mértékűnek.
Eddig sem a Moderna, sem a Pfizer vakcinával kapcsolatban nem fordult elő súlyos és kritikus COVID-19-hez hasonló, nemkívánatos mikrovaszkuláris vagy nagyobb ér trombotikus esemény. Az AstraZeneca és a Johnson & Johnson által gyártott adenovírusvektoros DNS-vakcinákkal kapcsolatban a sinus sagittalis és a lépvénákat érintő katasztrofális trombotikus szövődményekről számoltak be. Ennek pontos oka nem ismert, de klinikai párhuzamot vontak a heparin által kiváltott trombocitopéniával, amelyben a betegeknél a heparin és a trombocita 4 komplex ellen antitestek alakulnak ki. Nemrégiben kimutatták, hogy a humán trombociták ACE2-t és TMPRSS2-t, a felszíni szerinproteázt expresszálják a tüskefehérjék primingjéhez. Ezt követően kimutatták, hogy a SARS-CoV-2 tüskefehérje közvetlenül fokozta a vérlemezke-aggregációt és a vérrög retrakciót in vitro, és ezáltal a tüskefehérje trombusképződést eredményezett vad típusú egerekben, amelyeket hACE2 transzgenikus vérlemezkékkel transzfundáltak. Továbbá, a rekombináns humán ACE2 fehérje és a tüske elleni monoklonális antitest gátolta a SARS-CoV-2 tüskefehérje által kiváltott trombocita-aktivációt.9.
22 olyan beteget vizsgáltunk, akiknél a vakcina beadásához időben kapcsolódóan bőrreakciók alakultak ki. Valamennyi betegnél biopsziát végeztünk, és a mintákat laboratóriumainkba küldtük diagnosztikai értékelésre. Megvizsgáltuk a vakcinára adott kóros immunválasz jellemzőit, és a kiválasztott esetekben értékeltük a bőrön belüli vírus-tüskefehérje lokalizációjának és a mikrovaszkuláris komplement útvonal aktiválódásának és citokin expressziójának bizonyítékait a bőr mikroereiben10
Mivel a normál bőr biopsziája dokumentálhatja a szisztémás komplementaktivációt és a tüske glikoprotein lokalizációját a bőr mikroereiben súlyos és kritikus COVID-19 esetén, a tanulmány szerzői közül ketten néhány héttel a Pfizer vakcina első adagjának beadása után (de még a második oltás beadása előtt), egyikük pedig a Johnson & Johnson vakcina beadása után biopsziát vettek saját magukból, a tünetmentes deltoid bőrből. Szándékunk annak vizsgálata volt, hogy a vakcinából származó tüske glikoprotein lokalizálódhat-e pszeudovírusként a bőr mikroereibe, és ha igen, akkor ugyanolyan potenciális hatást gyakorolhat-e az endotélre, mint amit a súlyos és kritikus állapotú COVID-19-es betegek bőr ACE2+ mikroereiben megfigyeltünk.7,10,11.
Anyagok és módszerek
A vizsgálat során 22 olyan beteg bőrbiopsziás mintáit elemezték, akiknél a COVID vakcina beadását követően bőrkiütés alakult ki, és akik esetében a klinikai diagnózis a vakcina által kiváltott túlérzékenységi reakció volt. A vizsgálatba bevonták továbbá 3 olyan személy deltoid bőrbiopsziáját, akik COVID-19-ben haltak meg, továbbá 5, COVID-19 előtti bőrbiopsziás mintát. Egy korábban közzétett protokollt alkalmaztunk6,7, a kilnikai információk tekintetében "vakon" a szöveteket megvizsgáltuk a vírus tüske fehérje (egy olyan koktél, amely képes kimutatni az S1, S2 és receptor-kötő domén alegységeket), a SARS-CoV-2 membrán- és burkolófehérjék, az interleukin (IL)-6, a kaszpáz 3, az ACE2, a tumor nekrózis faktor α (TNFα), a C3d, C4d, MASP-2 és C5b-9 kimutatására.
A koexpressziós elemzést a Nuance rendszerrel (Nuance, Burlington, MA) végeztük.6,7 Megvizsgáltuk a tanulmány három orvos szerzőjének deltoid bőrbiopsziás mintáit is, ezek az orvosok nem szennvedtek COVID-19 fertőzésben, és közülük ketten az mRNS-alapú COVID-19 vakcinát kapták, és az oltás utáni 10. és 14. napon történt a vizsgálat, illetve a Johnson & Johnson vakcinával oltott személy esetén 10 nappal az oltás után. A szisztémás komplement útvonal aktiválódására utaló bizonyítékok értékelése érdekében egy 21 éves nő normál bőréből vett negyedik deltoid biopsziás mintát is vizsgáltak. Nála a Moderna vakcina beadásához időlegesen kapcsolódóan szívizomelégtelenség alakult ki. A vizsgálatra a 20-02021524 számú intézményi felülvizsgálati bizottság protokollja vonatkozik.
Eredmények
COVID-19 vakcina utáni bőrkiütések betegeken (22 eset)
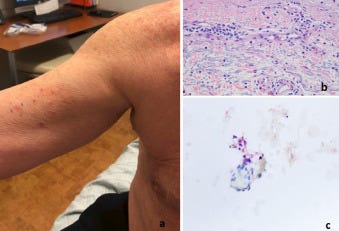
A bőrbiopsziák a rutin diagnosztikai bőrpathológiai gyakorlatunkban a COVID-19-hez kapcsolódó vakcinák beadását követően kialakult általános bőrkiütések értékelésére szolgáltak (1. táblázat). A betegpopulációt 10 nő és 12 férfi képviselte, akiknek életkora 23 és 96 év között volt, a medián életkor 53 év volt. A bőrkiütés kezdete minden esetben időben a vakcina beadásához kapcsolódott, és a legtöbb esetben generalizált papulovesicularis, ekcémás dermatitis és/vagy urticariás bőrkiütés formájában jelentkezett (1A, 2A, 3A, 3A, 4A és B, 5A, 6A, 7A, 8, 9A, 10. ábra). Egy betegnél a Moderna vakcina beadása után 1 héttel Grover-kór alakult ki. Egy másik beteg tünetei a guttált psoriasisnak feleltek meg, amely a Pfizer vakcina második adagját követően 2 héttel testszerte vörös, pikkelyes makulákkal jelentkezett (8A. ábra). Négy betegnél észleltek vaszkulitiszt, köztük két betegnél perniózisra emlékeztető akrális elváltozást, két betegnél pedig csalánkiütéses vaszkulitiszt. A Moderna vakcina beadását követően 11 betegnél jelentkeztek tünetek. A Pfizer vakcina beadása után hét betegnél jelentkeztek tünetek. Négy betegnél a beadott vakcina nem volt ismert. A reakciók öt betegnél az első adag után, kilenc betegnél pedig a második adag után jelentkeztek. Nyolc betegnél nem volt ismert, hogy a bőrkiütés az első vagy a második adag után következett-e be. A reakciók a vakcina beadását követően 1 naptól 4 hétig terjedő időszakban jelentkeztek. Tizenhét betegnél pontosabb időzítés volt ismert a vakcina beadása és a bőrkiütés kialakulása között. Nyolc betegnél a bőrkiütés az első vagy a második oltási adag beadását követő 1 héten belül alakult ki, köztük öt betegnél a bőrkiütés a vakcina beadását követő 48 órán belül alakult ki. Kilenc betegnél a reakció később jelentkezett, 8 nappal, 9 nappal, 10 nappal, 12 nappal, 2 héttel, 3 héttel és 4 héttel a vakcina beadását követően. Gyakori volt valamilyen fokú ízületi gyulladás és láz. Két betegnél ízületi duzzanatot figyeltek meg, köztük egy betegnél tüszős hólyagos-nyálkahártya-kiütést (9A. ábra), egy másik betegnél pedig trombocitopéniát és hemolízist. Egy betegnél jelentkezett eozinofília a perifériás vérben.


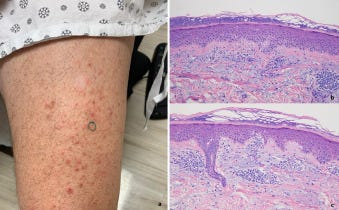
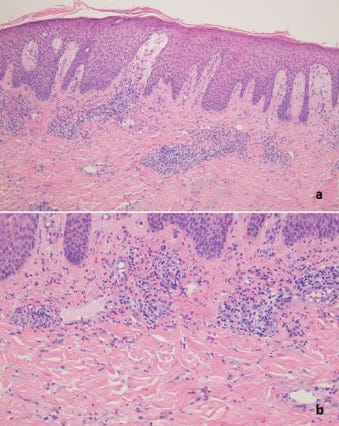
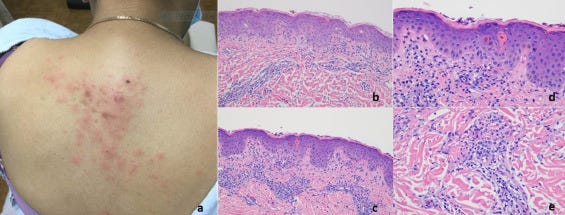

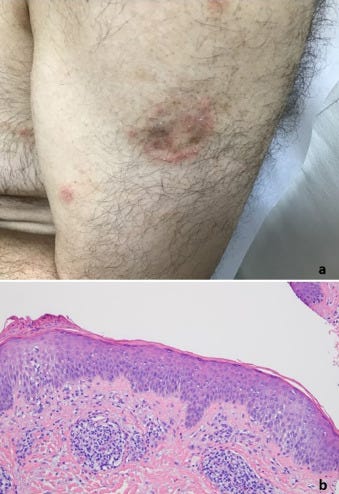



Fénymikoroszkópos vizsgálatok
A meghatározó szövettani mintázatok közé tartozott az ekcémás dermatitis (10 eset) (2., 4C-E, 5B, 6B, 7B ábra), a határfelületi dermatitis (13 eset) (1B és C, 2B és C, 3B és C, 4, 5, 7B, 11A ábra), a csalánkiütés (egy eset), a limfocita vasculitis (három eset), beleértve két esetben a perniosist (12A-C ábra), a Grover-kór (két eset) (13. ábra), urticariás vasculitis (két eset) (10B, 14A és B ábra), és granulomatosus gyulladás (három eset) (3., 6C, 11A és B ábra), amelyek közül az egyik interstitialis, a másik follikulocentrikus neutrofil és granulomatosus mintázatot mutat, amely a vesiculopustularis pyoderma gangrenosumra emlékeztet (9B-D ábra). 12 Ezenkívül 1 esetben klinikailag pustulákat észleltek, bár szövettanilag nem dokumentálták a pustuláris diatézist. A klinikai benyomás akut generalizált exanthematosus pustulosis volt. Egy másik esetben egy erythemás alapon lévő, fotogenetikusan eloszló papuláris erupciót mutattak ki. A legtöbb esetben egyéb, egymást átfedő morfológiai reakcióminták is voltak, amelyek hibrid dermatitist határoztak meg, beleértve a kombinált ekcémás, határfelületi, vaszkulitikus és interstitialis granulomatosus jellegzetességeket mutató eseteket. A leggyakoribb mintázat a hat esetben azonosított egyidejű határfelületi és ekcémás dermatitis volt. Gyakori volt a szöveti eozinofília. A klinikai benyomás minden esetben egyezett a szövettani leletekkel, és a kitörések vagy spontán, vagy helyi vagy szisztémás szteroidterápia hatására megszűntek, kivéve azt az esetet, amikor a bőrkiütés 4,5 hónapig fennállt. A beteg ezután ustekinumabot kapott. Az egyik eset megfelelt a guttate psoriasisnak, egy másik T-sejt-mediált folyamatnak, amelyben megállapították, hogy gyakran exogén antigénes kiváltó ok is szerepet játszik, bár jellemzően streptococcus antigénnel összefüggésben (8B. ábra). Egy másik esetben a pityriasis rubra pilaris kísérőjelenségeivel járó interfész dermatitis szokatlan képét figyelték meg. Az I. típusú interferon szignatúra a vizsgált öt esetből négyben, köztük 1 esetben perniosisban felszabályozott volt.

Immunhisztokémiai értékelés a tüske glikoprotein, a komplement lerakódás és az endoteliális citokinek (IL-6, kaszpáz 3 és TNFα) expressziójára vonatkozóan.
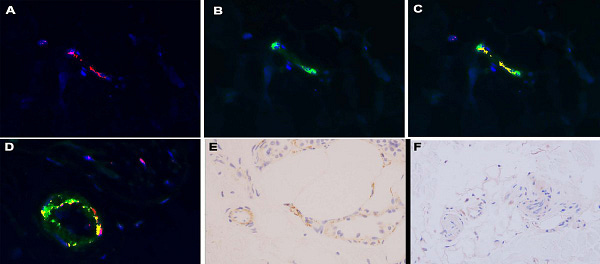
A festés célja az volt, hogy dokumentáljuk a humán szintézis bizonyítékát, és megállapítsuk, hogy a tüske glikoprotein képes pszeudovírusként dokkolni az ACE2+ erekhez, amely hipotézis a szisztémás komplement aktiváció alapjaként szerepel a súlyos és kritikus COVID-19 esetében. A megvizsgált 10 esetben dokumentálni tudtuk a tüske glikoproteint a bőr mikrovaszkuláris rendszerében. Különösen a retikuláris dermiszben és a szubkután zsírban voltak olyan ritka mélyen fekvő erek, amelyekben az endothelben fokálisan kimutatható volt a tüske glikoprotein, amely azt tükrözi, hogy a mélyebb mikroerekben az ACE2 expressziója előnyösebb. Jellemzően csak egy vagy legfeljebb néhány pozitív festődésű ér volt (kevesebb, mint 5) (11C és D, 12D ábra). Hasonló eloszlás volt megfigyelhető az IL-6, a kaszpáz 3 és/vagy a TNFα esetében, viszont jelentős mikrovaszkuláris komplement lerakódás nem volt (10C ábra). A mikrovaszkuláris tüske glikoprotein és az ACE2 expressziójának összmennyisége sokkal kisebb volt, mint a súlyos és kritikus COVID-19 trombotikus retiform purpura esetén megfigyelt mennyiség.


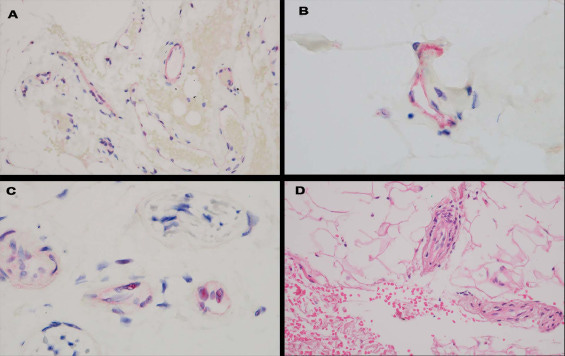
Vakcina utáni normális deltoid biopsziák tünetmentes betegeknél
Az oltás utáni két normális bőrbiopsziából vett két minta soros metszetei az egyik biopsziás mintában a bőr alatti zsírban egyetlen érben lokalizált limfocita érreakciót mutattak ki. Mindkét biopsziában az ACE2 expressziója volt kimutatható a mélyebb bőr- és bőr alatti mikroérben lévő endotheliumban. A COVID-19-ben elhunyt betegek deltoid bőrbiopsziás mintáiban a tüske glikoprotein jelentős mikrovaszkuláris endotélsejt lokalizációja volt kimutatható, míg a COVID-19 előtti bőrminták negatívak voltak (15. ábra). A Pfizer-vakcinát kapott betegek után vett két normál biopsziás mintában a mély dermisz és a bőr alatti bőr mikrovesszeiben található néhány endotélsejt pozitív volt a tüske glikoproteinre (kevesebb mint 5 mikroér, az endotélium belső sejtjeiben bizonyos fokú pozitivitással). A súlyos COVID-19-es betegek deltoid bőrbiopsziás mintáival ellentétben, amelyek az endotheliumon belül a burkoló és a membrán vírusfehérjéket is tartalmazták, ezek a további víruskapszidfehérjék hiányoztak a Pfizer-vakcinát kapott betegektől vett biopsziás mintákból (adatok nem szerepelnek) (16. ábra). A C3d, C4d és C5b-9 lerakódását vizsgáló komplementvizsgálatokat mindkét esetben elvégezték, és csak néhány érben mutattak ki komplementlerakódást, így nem támasztották alá a szisztémás komplementaktiváció diagnózisát. A Nuance szoftver (Nuance) koexpressziós elemzése a tüske glikoprotein kaszpáz 3-mal, TNFα-val és IL-6-tal való koexpresszióját mutatta ki (16. ábra). Egy további deltoid biopsziás mintát szereztek be egy másik orvos szerzőtől, aki Johnson & Johnson vakcinát kapott. A tüske glikoproteint nem azonosították 17. ábra.


Normális deltoid biopszia egy betegnél, akinek akut szívizomelégtelensége alakult ki a vakcinát követően.
A deltoid biopsziás mintát attól a 21 éves betegtől vették, aki 2021. március 12-én jelentkezett a sürgősségi osztályon a bal karjába sugárzó mellkasi fájdalommal, 2 nappal a második Moderna vakcináció után. A bőrbiopsziás mintán minimális perivascularis lymphocytás infiltrátum volt látható. A C5b-9 vizsgálatok nagyjából 8 pozitív festődést mutató eret mutattak, beleértve a kapillárisokat, vénákat és egy artériát, ezért nem feleltek meg a szisztémás komplementaktiváció bizonyítékaként szolgáló kritériumoknak. Egyetlen mély dermális ér mutatott tüske glikoprotein, TNFα és kaszpáz 3 pozitivitást.
Tárgyalás
Beszámoltunk egy sor, a Pfizer vagy a Moderna COVID-19 vakcina első vagy második dózisának beadásával időlegesen összefüggő nemkívánatos bőrreakciókról. Minden korcsoportba tartozó betegben kialakulhat vakcinareakció akár a Pfizer, akár a Moderna esetében. A bőrkiütések jellemzően generalizáltak voltak, és urtikáriás vagy ekcémás megjelenésűek. Az általunk vizsgált vizsgálatok során a Moderna vakcinával kapcsolatban gyakrabban fordultak elő reakciók, mint a Pfizer vakcinával összefüggésben. A mellékhatások ezen túlmenően akár az első, akár a második adag után is kialakulhattak, bár a második adag után majdnem kétszer olyan gyakori volt, mint az első adag után. A reakció kialakulhatott akár 48 órával a vakcina beadását követően, vagy akár 4 héttel később is, de az esetek csaknem felében a vakcina beadását követő egy héten belül jelentkezett.
Hiperszenzitivitásra hasonlító szövettani minták
A leggyakoribb szövettani mintázat az ekcémás dermatitis, a határfelületi dermatitis, az interstitialis granulomatosus dermatitis és a limfocita vasculitis volt, beleértve két esetben a perniosist is. Az általunk tapasztalt vakcinareakciók egyik jellemzője a hibrid gyulladásos mintázat volt. Egy-egy eset vegyes mintázatot mutathatott, amit legjobban a határfelületi és ekcémás dermatitis esetei példáznak, melyeket enyhe limfocita vaszkulitisz kísért. Ezek a specifikus szövettani minták általában a háttérben meghúzódó IV. típusú túlérzékenységet tükrözik. Egy esetben, amelyhez a határfelületi dermatitis feltűnő mintázata társult, egyidejűleg pityriasis rubra pilaris-szerű elváltozások is előfordultak. Ennek a betegnek legalább 4 hónapja tartósan súlyos, generalizált bőrkiütése volt, amely nem reagált a prednizonra, ezért elkezdődött az ustekinumab-kezelés. Az egyik biopsziás minta jellegzetes follikulocentrikus immunreakciót mutatott, amely a steril neutrofil follikulitisz kategóriájába tartozik follikulocentrikus érsérüléssel.13 Patogenetikai szempontból az ilyen típusú steril neutrofil tüszős reakcióról azt feltételezték, hogy TH1 domináns IV. típusú immunválaszt képvisel, amelyben a citokin miliő elősegíti a neutrofil beáramlást a bőrbe.13,14 Az eseteknek egy kisebb része urticariás vaszkulitiszt mutatott, amely a leukocitoklasztikus vaszkulitisz egy morfológiai alcsoportja, és jellemzően az immunkomplex lerakódások váltják ki, de más proinflammatorikus folyamatok is szerepet játszhatnak. Elképzelhető egy olyan forgatókönyv, amelyben a vakcina által bejuttatott, nem pontosan definiált idegen fehérjéhez kötött antitestek immunkomplexként lerakódhatnak a mikroerekben, és a klasszikus komplement útvonal beindításával neutrofilokban gazdag gyulladásos reakciót eredményezhetnek.
Genetikai eredetű dermatózisra emlékeztető posztvakcinális reakciók
Az egyik betegnél eruptív pikkelysömör alakult ki, kibővítve a IV-es típusú T-sejtes immunválasz klinikai és morfológiai spektrumát. Egyes COVID-19 vakcinakísérletek alapján egyre gyakrabban észlelik a bőrreakciókat, és noha a kezdeti kísérletek némelyikében eredetileg nem írtak le pikkelysömört, az influenza elleni vakcinát elismerték a guttata pikkelysömör kiváltójaként.15, 16, 17-18 A streptococcus antigének és a keratinok közötti molekuláris mimikri áll a pszoriázisos betegek epidermiszében a streptococcus-faringitisz és a guttatikus pszoriázis közötti kapcsolat hátterében. A tüske glikoprotein és a guttate psoriasisban szerepet játszó M6 fehérje szerkezeti homológiát mutat, bár nem specifikusan a SARS-CoV-2 tüske glikoproteinjére. A vakcinával összefüggő immunerősödés azonban szerepet játszhat a pikkelysömör felszínre hozásában egy genetikailag hajlamos betegnél. Két betegnél szövettanilag a Grover-kórt is kimutatták, bár ennek mechanizmusa nem világos.
Az oltás utáni bőrreakciókra vonatkozó szakirodalom áttekintése
Más szerzők a Pfizer és a Moderna COVID-19 vakcináját kapott betegeknél leírtak bőrkiütéseket, egyrészt generalizált kiütések, másrészt az oltás helyén kialakuló erythema formájában. Farinazzo és munkatársai Északkelet-Olaszországban először írták le a bőrreakciók regisztrált eseteit, azt követően, hogy a betegek Triesztben megkapták a Comirnaty-BioNTech/Pfizer mRNS COVID-19 vakcinát.19 Az összes oltott személy 0,22%-ánál jelentettek egy vagy több bőrgyógyászati mellékhatást, és az összes mellékhatás 16,54 százalékát tették ezek ki. A reakciókat a vakcina helyén fellépő, illetve a nem egybefüggő és általánosabb reakciókra osztották. A reakciók között volt csalánkiütés, maláris erythema, kéztáji bőrkiütés, pityriasis rosea és egy olyan reakció, amely hasonlított egy gyógyszeres állandó bőrkiütésre. A mellékhatások mind az első, mind a második adag után jelentkezhettek, és az oltás követő akár 60 órán belül megjelenhettek. A kiváltó ok megállapítására tett kísérlet során felmerült, hogy a 200-as polietilén-glikol lehet a felelős, amely az I. típusú azonnali túlérzékenység és a késleltetett reakciók ismert okozója. A polimerek leírására más kifejezéseket is használtak, mint például makrogol, oxietilénpolimer és laureth. Egy második áttekintésben, amely egy amerikai adatbázisból kigyűjtött több mint 400 bőrreakciót vizsgált, az esetek több mint 80%-a a Moderna vakcinával kapcsolatban fordult elő.17 A reakciók kevesebb mint 20%-a volt a Pfizer vakcinával kapcsolatos.17 A vakcinával kapcsolatos mellékhatások túlsúlyban voltak a nők körében. A mellékhatás a betegeknél az első vagy a második vakcinaadag beadása után is jelentkezhetett, és ha az első adag után jelentkezett, 40%-os valószínűséggel a második adag után is előfordult. Két alapvető időkeret volt: egy azonnali, amely 1-3 napon belül jelentkezett, és egy késleltetett, amely az oltóanyag beadása után 6-7 nappal alakult ki. A reakciók közé tartozott az oltás helyén jelentkező duzzanat, morbilliform kiütések, pityriasis rosea-szerű és chilblains/perniosis. Láttunk olyan eseteket, amikor az oltás utáni erythema a vakcina helyén jelentkezett, beleértve egy olyan esetet, amely egyidejűleg nyirokcsomó-gyulladással járt, de nem volt biopszia a gyulladásos válasz jellegének megerősítésére. A szerzők a vakcina hordozóanyagában használt bizonyos anyagokat, például polietilénglikolt jelölték meg a feltételezett kiváltó okként17.
Patogenezis
A vakcinavivőanyagban található valamely anyag allergénként betöltött szerepe
Ha általánosságban vizsgáljuk a vakcinákat, és nem konkrétan a SARS-CoV-2 mRNS-vakcinákat, a különböző vakcinákban található gyakori összetevők különféle szisztémás allergiás kontakt dermatitiszreakciókat válthatnak ki. A leggyakoribb bűnösök az antibiotikumok (pl. neomicin), bizonyos kulcsfontosságú tartósítószerek, mint például a formaldehid, a propilénglikol és a szorbinsav. Minden egyes betegnél, akinél mellékhatás jelentkezik, megfontolandó a tapaszpróba, hogy meghatározzuk, melyik komponens váltja ki az immunválaszt. A COVID-19 vakcinával kapcsolatos bőrreakciók láthatóan önkorlátozóak. A szövettan arra utal, hogy az alapját a más exogén antigénnel szemben megfigyelhető túlérzékenység két jellemző végpontja képezheti, bár ez nem bizonyított. A domináns mintázat egy szisztémás ekcematoid túlérzékenységi reakciónak felel meg. A mi sorozatunkban, valamint a más közölt tanulmányokkal összhangban, a leggyakoribb mintázat a IV. típusú túlérzékenységre emlékeztet, amelyet ekcémás dermatitis és vagy egyidejűleg kialakuló citotoxikus határfelületi dermatitis jellemez. Felmerülhet, hogy az antigén a vakcina beadásához használt hordozóanyagban előforduló egyik vegyület lehet, bár a myocyta által előállított tüske glikoproteinre adott T-sejtes és/vagy humorális reakció is felmerül, mint feltételezett kiváltó antigén, különösen annak a bőr mikroérrendszeri lokalizációját figyelembe véve. Lehetséges, hogy valamely olyan antigén, amely nem kapcsolódik a vakcinához, de amelyben az antigénre adott immunválasz a vakcinával összefüggő immunerősítés miatt válik láthatóvá.
A vakcinák különböző összetevőinek vizsgálata nélkül nehéz lenne az antigén kiváltó okának tisztázása. A Moderna COVID-19 vakcina a következőket tartalmazza: mRNS, lipidek (SM-102, polietilénglikol 2000 dimirisztoil-glicerin, koleszterin és 1,2-disztearoil-sn-glicero-3-foszfokolin), trometamin, trometamin-hidroklorid, ecetsav, nátrium-acetát-trihidrát és szacharóz. A Pfizer vakcina a következőket tartalmazza: mRNS, lipidek, beleértve a (4-hidroxibutil)azándiil)bisz(hexán-6,1-diil)bisz(2-hexildecanoátot), 2 [(polietilénglikol)-2000]-N,N-ditetradecilacetamid, 1, 2-disztearoil-sn-glicero-3-foszfokolin és koleszterin) kálium-klorid, monobázisos kálium-foszfát, nátrium-klorid, kétbázisú nátrium-foszfát-dehidrát és szacharóz. Számottevő figyelmet fordítottak a polietilénglikolra, mint feltételezett antigén kiváltó tényezőre.
Az összes COVID-19-vakcinareakciót a Moderna vakcinát vagy a Pfizer vakcinát követően figyelték meg a betegeknél. A Johnson & Johnson vakcina egy vírusvektoros vakcina, amely egy olyan replikáció-inkompetens rekombináns adenovírus vektort használ, amely a SARS-COV-2 tüskefehérjét stabilizált konformációban expresszálja. A stabilizált változat két olyan mutációt tartalmaz, amelyekben az aminosavakat prolinokra cserélték. Ezenkívül a vakcina olyan inaktív összetevőket tartalmaz, mint a citromsav-monohidrát, de nem tartalmaz polietilénglikolt. E tényezők kombinációja lehet az alapja annak, hogy a Johnson & Johnson vakcinát miért nem hozták összefüggésbe ezekkel a túlérzékenységi reakciókkal.18, 19, 20.
A szisztémás kontakt dermatitisz mechanizmusa szerepet játszhat az oltás utáni reakciók kialakulásában.
A szisztémás kontakt dermatitiszről szóló korábbi tanulmányok21,22 azt sugallták, hogy egy rendszeresen bejuttatott antigén és egy olyan lokális szer közti keresztreaktivitás állhat a szisztémás ekcémás reakció patofiziológiájának hátterében, amelyre a beteg szenzitívvé vált. Ebben a folyamatban a Langerhans-sejtekkel együtt az antigénnel előkészített memória-T-sejtek is részt vesznek,21 és a memória-T-sejtek a bőr azon pontjaira szerveződnek, ahol korábban a lokális hatóanyagot alkalmazták. Az egymástól távol eső helyek is begyulladhatnak, hasonlóan a bőrfelületi dermatitis reakcióhoz, amely az elsődleges dermatózistól távol eső bőrfelületeken jelentkezik. Az allergének nem helyileg, hanem különböző útvonalakon, például lenyeléssel, intravénás beadással vagy intramuszkuláris injekcióval, például vakcina útján jutnak a vérkeringésbe. A klinikai kép meglehetősen változatos - a bőr manifesztációi között szerepel az allergiás kontakt dermatitis korábbi helyén kialakult bőrkiütés, a korábbi tapaszvizsgálat helyén kialakult bőrkiütés, hólyagos kézdermatitis, valamint a könyökön és a térden megjelenő viszkető papulák, eritroderma és kisér-vasculitis-szerű elváltozások. A kiváltó szisztémás antigén, például egy gyógyszer metabolizmusa után a bőrben, ahol az egy hapten-hordozó komplexként működik, az antigén a prezentáló sejtek által feldolgozott T-sejtek helyi nyirokcsomóban történő klonális expanziójához vezet, amelyek ezután a bőrbe vándorolhatnak és IV. típusú immunválaszt válthatnak ki. A memória T-sejtek a bőr lymphocyta antigént expresszáló sejtjeihez előnyösen kötődnek, ami a perifériás vérben a memória T-sejtek relatív csökkenéséhez vezet. Egy másik mechanizmus az úgynevezett p-1 koncepció, amely szerint a gyógyszerek közvetlenül egy T-sejt-receptorhoz kötődnek. Nem történik közvetlen találkozás a fő hisztokompatibilitási komplexszel, és nincs előzetes metabolizmus. Függetlenül a pontos mechanizmusoktól, a vakcinával összefüggő bőrreakciók legalább egy részét a szisztémás kontakt dermatitiszre felhozott mechanizmusokkal lehet magyarázni, mivel a jól ismert bőrszenzibilizátor - polietilénglikol - megtalálható mind a Pfizer, mind a Moderna COVID-19 vakcinakészítményeiben.21
A tüske glikoprotein, mint az oltás utáni reakció potenciális kiváltója
Tekintettel arra, hogy a reakciók némelyike hasonlít az enyhe COVID-19-ben előforduló klasszikus bőrgyógyászati tünetekre, mint például a pityriasis rosea (azaz azok az esetek, amelyekben hibrid interfész és ekcémás dermatitis látható, egyidejűleg gyenge lymphocytás érsérüléssel), interstitialis granulomatosus gyulladás, kisérgyulladás és chilblains/perniosis, meg kell fontolni, hogy az oltási reakció további lehetséges jelöltje lehet az új fehérje, amelyet a genetikailag módosított myocyták állítanak elő. Egy másik kérdés, hogy a túlérzékenység lokalizációja bármilyen módon összefügg-e a tüske-glikoprotein in situ bőrön belüli lokalizációjával, mivel a bőr mikroereiben az ACE2 expressziójának szintje viszonylag magas más szervi helyekhez képest. Valóban, a tüske-glikoprotein értékelésére szolgáló immunhisztokémiai festés következetesen reprodukálható eredményeket mutatott minden vizsgált mintában. A festés elvégzésének alapja a humán szintézis bizonyítékának dokumentálása és annak megállapítása volt, hogy a tüske glikoprotein képes pszeudovírusként dokkolni az ACE2+ érhez, amely hipotézis a szisztémás komplementaktiváció alapjául szolgál a súlyos és kritikus COVID-19 esetében. Minden vizsgált esetben ki tudtuk mutatni a tüskeglikoproteint a bőr mikrovaszkuláris rendszerében. Különösen a mély retikuláris dermiszben és a zsírban voltak esetenként olyan mélyen fekvő erek, amelyek az endotéliumban fokális spike-glikoprotein expressziót mutattak, ami nem meglepő, mivel ez tükrözi az ACE2 preferenciális expresszióját a mélyebb dermális és szubkután mikroerekben. Azonban csak ritkán voltak pozitív festődésű erek. Hasonló eloszlás volt megfigyelhető az IL-6, a kaszpáz 3 és/vagy a TNFα esetében is, de jelentős mikrovaszkuláris komplementlerakódás nem volt megfigyelhető. A tüske glikoprotein teljes mennyisége a mikroerekben sokkal kisebb volt, mint amit a súlyos és kritikus COVID-19 trombotikus retiform purpurában megfigyeltünk. Annak ellenére, hogy a tüske az izomsejt élettartamára (azaz 10-16 évre) termelődik, a gyártott tüskére adott válaszként kialakuló semlegesítő antitest valószínűleg megakadályozza a tüske glikoprotein lokalizációját a távoli ACE2 pozitív mikrovaszkuláris ágyakban a humorális immunitás elérése után; azonban abban a korai időszakban, amikor a teljes adaptív immunitás még nem érte el a tüske glikoprotein kötődésének semlegesítését, a keringő pszeudovírusokra adott immunválasz nagyon is lehetséges (18. ábra).
A COVID-19 vakcina utáni reakció nagyrészt bőrre korlátozódó reakció, de nem minden esetben
A szisztémás és/vagy több szervet érintő parenchymás diszfunkció hiánya arra utal, hogy a bőr kifejezetten célpontja ezeknek a szövődményeknek. Sok esetben a bőrreakció nem része a vakcina által kiváltott többszervi nemkívánatos túlérzékenységi reakciónak, hanem a gyulladás a legtöbb esetben a bőrre korlátozódik. Előfordult néhány rendkívüli eset, amikor a reakciót súlyosabb ízületi duzzanat és follikulocentrikus vaszkulitiszes folyamat jellemezte, így például egy 27 éves nőnél és egy 23 éves férfinál, akiknél láz, vérzés, trombocitopénia és bőr alatti limfocita és granulomatózus vaszkulitisz alakult ki. A hemolízis esetei a COVID-19 vakcina beadását követően olyan betegeknél fordultak elő, akiknek a kórtörténetében korábban paroxysmalis nocturnalis hemoglobinuria okozta hemolízis szerepelt, és akiknél azt feltételezték, hogy a vakcinával kapcsolatos gyulladásos reakció a komplement útvonal aktiválódását váltja ki, szemben a tüske glikoprotein vörösvérsejt hemolízist okozó közvetlen hatásával.23 Ebben a konkrét esetben, bár a bőrkiütés tipikusan COVID-19-vakcina reakció volt, mivel a felületi dermatitisz kombinálódott a limfocita és granulomatosus vasculitissel, a szisztémás komplement útvonal aktiválódására is volt bizonyíték. A betegről nem volt ismert, hogy korábban hemolizissal járó betegségben, például atípusos hemolitikus urémiás szindrómában szenvedett volna. Egy másik 21 éves betegnél myocardialis diszfunkció alakult ki, és a képalkotó vizsgálatok myocarditisre utaltak. A deltoid bőrbiopszia nem mutatott semmilyen bizonyítékot túlzott I. típusú interferon jelátvitelre, sem szisztémás komplement útvonal aktiválódására, ellentétben a túlzott komplement érrendszeri lerakódásának mintázatával, amelyet a súlyos COVID-19-ben szenvedő betegek normál deltoid bőrbiopsziáiban látunk, beleértve egy korábban bejelentett beteget, akinél jelentős myocardialis betegség alakult ki, amely valószínűleg a myocarditis kis érrendszeri vaszkulitiszes változatát képviseli a súlyos COVID-19-ben. 7 Ezenkívül a mikroerekben lokalizált tüske glikoprotein mennyisége és az endotél alapú citokinválasz hasonló volt, mint a két egészséges felnőttnél, akiknél a vakcina beadását követően deltoid biopsziát végeztek. Az mRNS COVID-19 vakcinát kapott 30 éves vagy annál fiatalabb személyeknél 226 esetben fordult elő szívizom- vagy szívburokgyulladás, amely a második adag után gyakrabban fordult elő, és nagyobb arányban fordult elő férfiaknál. A tünetek közé tartozik a mellkasi fájdalom, emelkedett szívizom enzimek, ST- vagy T-hullám változások, nehézlégzés és rendellenes echokardiográfia/képalkotó vizsgálati eredmények. A betegek jellemzően teljesen felépülnek.24 A szívizom gazdag ACE2-pozitív mikroerekben. Már kimutattuk, hogy a humán szintetizált tüske-glikoprotein a mélyebb dermisz és a zsír ACE2-pozitív érrendszerében lokalizálódik. Hasonlóan enyhe lokalizációra számítunk más olyan szervekben is, amelyekben a mikroerek ACE2-t expresszálnak, mint például a szívben. Mivel a humán tüske glikoproteinre változatlanul T-sejt és B-sejt válaszok váltódnak ki, a szívben bizonyos fokú gyulladás alakulhat ki, ami az antigén lokalizációját tükrözi.
A vakcinának mint adjuvánsnak a szerepe az adaptív immunválasz kiváltásában az erre hajlamos gazdaszervezetben
Minden vakcina tartalmaz adjuvánsokat, amelyeket az adaptív és a veleszületett immunválasz fokozása érdekében adnak hozzá. Például a bacille Calmette-Guerin fokozza a hólyagrákot célzó autoreaktív T-sejtek tumorölő képességét. Az adjuváns szerepet játszik az antigénprezentációban részt vevő molekulák és más pro-inflammatorikus citokinek aktiválásában, és ezáltal az immunrendszer beindításában. Az mRNS-vakcinákban az adjuvánsok lipid- vagy polimeralapú nanorészecskék, amelyek védik és stabilizálják a törékeny mRNS-t, és javítják annak felvételét az immunsejtjek által. Maga az mRNS-nukleinsav eredendően immunstimuláló molekula, mivel a sejtfelszínen, az endoszómában és a citoplazmában lokalizált különféle veleszületett immunreceptorok felismerik. Logikus, hogy veleszületett immunrendszerünk arra van beprogramozva, hogy az idegen nukleinsavat fenyegetésként ismerje fel.25 Az adaptív TH1 vagy TH2 immunválaszhoz kapcsolódó proinflammatorikus citokinek magas szintje miatt bizonyos esetekben olyan mikrokörnyezet működhet, amely kedvez a TH1 vagy TH2 immunpolarizációhoz kapcsolódó gyulladásos sejtek beáramlásának. Ha van genetikai hajlam a pikkelysömör vagy atópiás dermatitis kialakulására, a vakcina kiválthatja a gyulladásos kaszkádot, amely egy adott dermatózisban, például dermatitisben végződhet. Másfelől egy szubklinikai túlérzékenységi reakció is lelepleződhet.26,27,27
Az új mRNS COVID-19 vakcinák biztonságosságára vonatkozó adatok hiánya miatt aggodalomra ad okot a gyulladásos betegségekben szenvedő betegekre gyakorolt hatása. Általánosságban elmondható, hogy a vakcinázás nem gyakori tényező a pikkelysömör fellángolásának kiváltásában. A vakcinázás és e bőrbetegség újonnan történő kialakulása vagy súlyosbodása közötti összefüggésről már beszámoltak. A vakcinázást követő pikkelysömör súlyosbodásáért felelős mechanizmusok még nem ismertek. Lehetséges, hogy az influenza elleni vakcinákhoz hasonlóan ezt a mechanizmust a vírusösszetevők és a vakcina adjuvánsok okozta immunrendszeri diszreguláció egyaránt okozhatja.16,28
Az ember által előállított tüske glikoprotein nem eredményez szisztémás komplement útvonal aktiválódást és érrendszeri sérülést
A tüske-glikoprotein mikrovaszkuláris lokalizációja ellenére úgy tűnik, hogy jelentős mikrovaszkuláris következmények nem jelentkeznek, ami azt tükrözi, hogy a szisztémás keringésben a gyártott tüske-glikoprotein terhelése alacsony, és hogy a gazdaszervezet által termelt antitestek fokozatosan semlegesítik a humán szintetizált tüskefehérjét. Az adatok azt mutatják, hogy a tüske glikoprotein sikeres előállítása az mRNS vakcinázást követően megtörtént. A tüske glikoprotein semlegesítésére irányuló adaptív immunválasz előtti, kialakulóban lévő időszakban nem meglepő, hogy a keringő tüskefehérje a mélyebb bőrerekben elhelyezkedő ACE2 pozitív endotéliumhoz lokalizálódik. Az endotélen keresztül endocitált humán eredetű tüske glikoprotein endotélsejtválaszt eredményezett, mivel a kaszpáz 3, az IL-6 és a TNFα fokális expresszióját mutatta; azonban nem járt együtt a komplement útvonal - a súlyos és kritikus COVID-19 esetén beinduló kritikus útvonal - aktiválásával, amelyik egyébként jelentősen hozzájárul a súlyos és kritikus COVID-19-et jellemző mikrovaszkuláris és prokoaguláns szövődményekhez. A komplementaktiváció hiányának alapja nem világos, de szerepet játszhat a receptor kötőhelyére lokalizált fehérje mennyisége, valamint a vad típusú tüskefehérje és a vakcinázott szívizomsejtek által szintetizált fehérje glikozilációs mintázatának különbsége. Annál a fiatal nőnél, akinél a Moderna COVID-19 vakcina beadását követően szívizomelégtelenség alakult ki, nem volt trombotikus elváltozás, és nem volt nyoma a komplement útvonal aktiválódásának. Ezenkívül a tüske glikoprotein lerakódásának mennyisége minimális volt, és összhangban volt a többi esetben megfigyelt lerakódás mértékével. Az emberi eredetű tüskés glikoprotein távoli mikrovaszkuláris ágyakban történő lokalizációjának hátterében álló patogenetikai események összefoglalása a 18. ábrán látható.

1. A tüskefehérjét kódoló mRNS-t egy lipid nanorészecske burkolja kívülről. 2. A miociták szintetizálják a tüskefehérjét, amely aztán a keringésbe kerül. 3. A spike pszeudovírusként jut a véráramba. 4. Az angiotenzin konvertáló enzim 2 (ACE2) a bőr alatti mélyebb erek endothelén (piros kromagén kiemeli az ACE2 pozitív ereket, kék nyíl). 5. A tüske a bőr ACE2-pozitív mikroerekhez kötődik (piros kromagén kiemeli a tüskét az endothelben, kék nyíl). A vakcina beadását követő kezdeti fázisban a tüskefehérje a véráramba kerülhet, és kis mennyiségben lokalizálódhat az ACE2-pozitív erekben.
Annak alapján, hogy a beoltott betegek bőrében lévő mikro vérerekben a tüskefehérjét azonosítottuk, nem meglepő, hogy az mRNS-vakcina alapján terlmet tüskefehérje kimutatható a perifériás vérben. Egy, a Moderna mRNS-1273 vakcinával oltott 13 bostoni egészségügyi dolgozó bevonásával végzett vizsgálat során a tüskefehérje S1 alegységének a jelenléte az 1. napon kezdődően kimutatható volt, és a mennyisége az 525. napon érte el a csúcspontját. Bár az S1 alegység a 14. napra az ellenanyagszint emelkedésével nem volt kimutatható, az intakt tüskefehérje sokkal tovább megőrződött egyes egészségügyi dolgozókban. Bizonyított, hogy maguk az mRNS-vakcinák a szervezetben jelentős mértékben eloszlanak. Az egyik gyártótól származó, a japán szabályozó hatóságoknak benyújtott jelentés szerint a lipid nanorészecskék biodisztribúciója injektált patkányokban azt mutatta, hogy az inokulum akár 75%-a is kikerült az injekció beadásának helyéről, és azt a vérben keringve, valamint a lépben, a májban, a csontvelőben, a mellékvesékben, a petefészkekben és más szövetekben összegyűlve találták meg.29,30
Következtetések
Összefoglalva, az adatok azt mutatják, hogy a legtöbb COVID-19 vakcina utáni bőrkiütés alapja IV. típusú túlérzékenységi reakcióra, ritkábban pedig immunkomplex-mediált túlérzékenységre utal. A pontos antigén kiváltó okot még nem állapították meg, de a lehetőségek között szerepel a vakcinavivőanyagban található exogén ágens, nevezetesen a polietilénglikol, illetve az emberi izomsejtek által termelt idegen tüskefehérje, amely szisztémás antigénként képes kiváltani a túlérzékenység klasszikus formáit, különösen a IV. típusú hiperszenzitivitást, emellett immunkomplex lerakódásokat. Figyelembe kell venni egy nem kapcsolódó antigént is, vagy egy olyan gyulladásos bőrbetegségre, mint a pikkelysömör, való genetikai hajlamot, amely a vakcina immunerősítő tulajdonságai miatt kerül felszínre. Az ACE2+ mikrovaszkulárisba disszeminálódó, kivételesen kis mennyiségű tüske glikoprotein nem eredményez a súlyos vagy kritikus COVID-19-hez hasonló súlyos vagy kritikus megbetegedést, ezért nem meglepő módon nem figyelhető meg a komplement útvonal aktivációja, és bár a COVID-19 vakcina beadását követően ritkán jelentettek trombotikus érrendszeri szövődményeket, nem bizonyított, hogy azokat a vakcina okozta volna.
Hivatkozások
1R Chilamakuri, S. AgarwalCOVID-19: characteristics and therapeuticsCells, 10 (2021), p. 206 View PDFCrossRefView Record in ScopusGoogle Scholar
2KR Murphy, NC Patel, D Ein, et al.Insights from American College of Allergy, Asthma, and Immunology COVID-19 Vaccine Task Force: allergic reactions to mRNA SARS-CoV-2 vaccinesAnn Allergy Asthma Immunol, 126 (2021), pp. 319-320ArticleDownload PDFView Record in ScopusGoogle Scholar
3G Forni, A MantovaniCOVID-19 Commission of Accademia Nazionale dei Lincei, Rome. COVID-19 vaccines: where we stand and challenges aheadCell Death Differ, 28 (2021), pp. 626-639 View PDFCrossRefGoogle Scholar
4U Sahin, A Muik, E Derhovanessian, et al.COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responsesNature, 586 (2020), pp. 594-599 View PDFCrossRefView Record in ScopusGoogle Scholar
5LA Jackson, EJ Anderson, NG Rouphael, et al.An mRNA vaccine against SARS-CoV-2—preliminary reportN Engl J Med, 383 (2020), pp. 1920-1931 View PDFCrossRefGoogle Scholar
6CM Magro, J Mulvey, J Kubiak, et al.Severe COVID-19: a multifaceted viral vasculopathy syndromeAnn Diagn Pathol, 50 (2020), Article 151645Google Scholar
7C Magro, JJ Mulvey, D Berlin, et al.Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: a report of five casesTransl Res, 220 (2020), pp. 1-13ArticleDownload PDFView Record in ScopusGoogle Scholar
8GJ Nuovo, C Magro, T Shaffer, et al.Endothelial cell damage is the central part of COVID-19 and a mouse model induced by injection of the S1 subunit of the spike proteinAnn Diagn Pathol, 51 (2020), Article 151682Google Scholar
9S Zhang, Y Liu, X Wang, et al.SARS-CoV-2 binds platelet ACE2 to enhance thrombosis in COVID-19J Hematol Oncol, 13 (2020), p. 120 View PDFCrossRefGoogle Scholar
10CM Magro, S Momtahen, JJ Mulvey, AH Yassin, RB Kaplan, JC. LaurenceRole of the skin biopsy in the diagnosis of atypical hemolytic uremic syndromeAm J Dermatopathol, 37 (2015), pp. 349-356View Record in ScopusGoogle Scholar
11JJ Mulvey, J Laurence, S Seshan, et al.Docked severe acute respiratory syndrome coronavirus 2 proteins within the cutaneous and subcutaneous microvasculature and their role in the pathogenesis of severe coronavirus disease 2019Hum Pathol, 106 (2020), pp. 106-116Google Scholar
12CM Magro, AN. CrowsonA distinctive vesiculopustular eruption associated with hepatobiliary diseaseInt J Dermatol, 36 (1997), pp. 837-844View Record in ScopusGoogle Scholar
13CM Magro, AN. CrowsonSterile neutrophilic folliculitis with perifollicular vasculopathy: a distinctive cutaneous reaction pattern reflecting systemic diseaseJ Cutan Pathol, 25 (1998), pp. 215-221 View PDFCrossRefView Record in ScopusGoogle Scholar
14AN Crowson, MC Mihm Jr, C. MagroPyoderma gangrenosum: a reviewJ Cutan Pathol, 37 (2003), pp. 97-107View Record in ScopusGoogle Scholar
15Janssen Vaccines & Prevention B.V. Clinical Trials. A randomized, double-blind, placebo-controlled phase 3 study to assess the efficacy and safety of Ad26. COV2. S for the prevention of SARS-CoV-2-mediated COVID-19 in adults aged 18 years and older. https//clinicaltrials.gov/ct2/show/NCT04505722. Accessed August 3, 2021.Google Scholar
16AT Gunes, E Fetil, S Akarsu, O Ozbagcivan, L. BabayevaPossible triggering effect of influenza vaccination on psoriasisJ Immunol Res, 2015 (2015), Article 258430View Record in ScopusGoogle Scholar
17DE McMahon, E Amerson, M Rosenbach, et al.Cutaneous reactions reported after Moderna and Pfizer COVID-19 vaccination: a registry-based study of 414 casesJ Am Acad Dermatol, 85 (2021), pp. 46-55ArticleDownload PDFView Record in ScopusGoogle Scholar
18Food and Drug Administration. FDA briefing document: Janssen Ad26. COV2. S vaccine for the prevention of COVID-19. Vaccines and Related Biological Products Advisory Committee Meeting. https//fda.gov/media//146217/download. Accessed August 3, 2021.Google Scholar
19Farinazzo E, Ponis G, Zelin E, et al. Cutaneous adverse reactions after m-RNA COVID-19 vaccine: early reports from Northeast Italy [e-pub ahead of print]. J Eur Acad Dermatol Venereol. doi:10.1111/jdv.17343, accessed May 22, 2021.Google Scholar
20Cross R. The tiny tweak behind COVID-19 vaccines. Chemical Engineering News. https//cen.acs.org/pharmaceuticals/vaccines/tiny-tweak-behind-COVID-19/98/i38. Accessed August 3, 2021.Google Scholar
21RP Usatine, M. RiojasDiagnosis and management of contact dermatitisAm Fam Physician, 82 (2010), pp. 249-255View Record in ScopusGoogle Scholar
22KE Andersen, N Hjorth, T. MennéThe baboon syndrome: systemically-induced allergic contact dermatitisContact Dermatitis, 10 (1984), pp. 97-100 View PDFCrossRefView Record in ScopusGoogle Scholar
23GF Gerber, X Yuan, J Yu, et al.COVID-19 vaccines induce severe hemolysis in paroxysmal nocturnal hemoglobinuriaBlood, 137 (2021), pp. 3670-3673ArticleDownload PDFCrossRefView Record in ScopusGoogle Scholar
24Centers for Disease Control and Prevention. Myocarditis and pericarditis following mRNA COVID-19 vaccination. https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/myocarditis.html. Accessed August 3, 2021.Google Scholar
25Q Huang, J Zeng, J. YanCovid-19 mRNA vaccinesJ Genet Genomics, 48 (2021), pp. 107-114ArticleDownload PDFView Record in ScopusGoogle Scholar
26Magro CM, Scheck L, Soleymani AD. Unmasking of a TH1-mediated vitiligo-like tendency in the setting of dupilumab therapy for adult atopic dermatitis. The Dermatologist. https://www.hmpgloballearningnetwork.com/site/thederm/article/unmasking-th1-mediated-vitiligo-tendency-setting-dupilumab-therapy-adult-atopic-dermatitis. Accessed August 3, 2021.Google Scholar
27SJ Dalton, MR Haeney, L Patel, TJ. DavidExacerbation of atopic dermatitis after bacillus Calmette-Guérin vaccinationJ R Soc Med, 91 (1998), pp. 133-134 View PDFCrossRefView Record in ScopusGoogle Scholar
28Krajewski PK, Matusiak Ł, Szepietowski JC. Psoriasis flare-up associated with second dose of Pfizer-BioNTech BNT16B2b2 COVID-19 mRNA vaccine [e-pub ahead of print]. J Eur Acad Dermatol Venereol. doi:10.1111/jdv.17449, accessed 16 Jun, 2021.Google Scholar
29Ogata AF, Cheng C, Desjardins M, et al. Circulating SARS-CoV-2 vaccine antigen detected in the plasma of mRNA-1273 vaccine recipients [e-pub ahead of print]. Clin Inf Dis. doi:10.1093/cid/ciab465, accessed 20 May, 2021.Google Scholar
30P. DoshiCovid-19 vaccines: in the rush for regulatory approval, do we need more data?BMJ, 373 (2021), p. n1244 View PDFCrossRefView Record in ScopusGoogle Scholar