Sandhya Bansal, Sudhir Perincheri, Timothy Fleming, Christin Poulson, Brian Tiffany, Ross M. Bremner és Thalachallour Mohanakumar tanulmánya
J Immunol 2021. november 15., 207 (10) 2405-2410; DOI: https://doi.org/10.4049/jimmunol.2100637.
Absztrakt
A SARS-CoV-2 (súlyos akut légúti szindróma koronavírus 2) súlyos akut légúti szindrómát okoz. A SARS-CoV-2 tüskefehérjére kifejlesztett mRNS-vakcinák eredményeként kialakultak az antitestek (Abs) és az immunitás. A hatásmechanizmus feltárása érdekében elemeztük a keringő exoszómák SARS-CoV-2 tüskefehérjével és antitesttel (Ab) történő indukciójának kinetikáját egészséges emberek vakcinázását követően. A eredmények azt mutatták, hogy a vakcinázást követő 14. napon a keringésben a tüskefehérjét expresszáló exoszómák jelennek meg, majd a második dózis után 14 nappal az antitestek is megjelentek. A tüskefehérjét hordozó exoszómák, a SARS-CoV-2 tüske elleni antitestek, valamint az IFN-γ és TNF-α szekréciót termelő T-sejtek száma megnövekedett az emlékeztető (2.) dózist követően. Az exoszómák transzmissziós elektronmikroszkópos vizsgálata a felszínükön lévő tüskefehérje antigént (Ag) is kimutatta. A tüskefehérjét és antitesteket tartalmazó exoszómák mennyisége párhuzamos csökkenést mutatott négy hónap elteltével. Ezek az eredmények azt mutatják, hogy az mRNS-alapú vakcinázást követő hatékony immunizálásban fontos szerepet játszanak a tüskefehérjét tartalmazó keringő exoszómák. További bizonyíték erre a humorális és celluláris immunválaszok előidézése a tüskefehérjét hordozó exoszómákkal immunizált egerekben.
Bevezetés
A 2019. évi koronavírus-betegség (COVID-19) világjárványt a súlyos akut légzőszervi tüneteket okozó 2. számú koronavírus (SARS-CoV-2) okozza. A legtöbb fertőzött ember spontán felépül, enyhe tüneteket mutatva, ugyanakkor a SARS-CoV-2 fertőzés súlyos, gépi lélegeztetést igénylő, ∼1%-os halálozással járó akut légzőszervi megbetegedést is okozhat. Az immunitás kiváltására és a SARS-CoV-2 fertőzés súlyosságának csökkentésére többféle vakcinát fejlesztettek ki (1, 2). A Betegségellenőrzési és Megelőzési Központ (CDC) legutóbbi frissítései szerint a SARS-CoV-2 betegek halálozási aránya négyszer magasabb a 30-39 évesek körében a 18-29 évesekhez képest, és 600-szor magasabb a 85 éves és idősebb betegek körében. (Forrás itt.)
A Pfizer-BioNTech és a Moderna által kifejlesztett SARS-CoV-2 vírusfertőzés elleni mRNS-alapú vakcinák sürgősségi felhasználási engedélyt kaptak az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatóságától (3, 4, 5). Ezek a vakcinák humorális és celluláris immunválaszok kialakításával védik a recipienseket a SARS-CoV-2 fertőzéssel szemben. A vakcinázás jótékony hatását gyakran a tüskefehérjére adott antitesválaszok mérésével határozzák meg (6). Jelen vizsgálatban olyan nyolc egészséges felnőtt vizsgálatát végeztük el, akik megkapták a SARS-CoV-2 vakcina (Pfizer-BioNTech) mindkét adagját. Eredményeink azt mutatták, hogy a 14. napra megjelentek a keringésben a SARS-CoV-2 tüskefehérjét hordozó keringő exoszómák, miközben a laboratóriumunkban kifejlesztett ELISA-módszerrel a szérumokban nem volt kimutatható a tüskefehérjére antitest. A keringő antitestek csak a második emlékeztető vakcinaadag után (14. nap) voltak kimutathatók, ugyanakkor a tüskefehérjét tartalmazó exoszómák mennyisége a ∼12-szeresére nőtt. E redményeink határozottan alátámasztják azt, hogy az exoszómák indukciójának fontos szerepe van az immunizációt követő immunválaszban. Mindezeket alátámasztja az a vizsgálati eredményünk is, hogy a beoltott emberből származó, tüskefehérjét tartamazó exoszómákkal immunizált egereknél a SARS-CoV-2 tüskefehérjére specifikus antitestek alakultak ki.
Anyagok és módszerek
Betegcsoport és demográfiai adatok
Nyolc olyan egészséges felnőtt önkéntest vizsgáltunk, akiket az mRNS-alapú SARS-CoV-2 vakcinával (Pfizer-BioNTech) oltottak be. Vért vettünk az oltás előtt, az első adagot követő 7. és 14. napon, a második adagot követő 14. napon, valamint mindkét adag után 4 hónappal. A vizsgálatot a Szent József Kórház intézményi felülvizsgálati bizottsága hagyta jóvá Institutional Review Boards (IRB) at St. Joseph’s Hospital (IRB number PHXB16-0027-10-18).
Exoszóma izolálás és a nanorészecskék nyomkövető elemzése
Az exoszómákat 500 µl plazmából izoláltuk az Invitrogen Exosome Isolation Kit segítségével, amelyet 0,22 mikronos szűrés követett (7). Minden exoszómának a méretét NanoSight NS300 (Malvern Panalytical, Great Malvern, Egyesült Királyság) segítségével elemeztük, és a kísérleteinkben használt részecskék átlagos mérete <200 nm volt (8).
SARS-CoV-2 tüskefehérje és nukleokapszid fehérje specifikus antitestek kimutatása az emberi plazmából származó mintákból
Az antitestek kialakulását a SARS-CoV-2 tüske-Ag-hez a laboratóriumunkban kifejlesztett ELISA segítségével határoztuk meg. Röviden, a SARS-CoV-2 tüskefehérjét (Sino Biological) 1 μg/ml PBS-ben felvitték egy ELISA-lemezre, és egy éjszakán át 4°C-on inkubáltuk. Ezekhez a lemezekhez 1:750-es hígításban humán plazmát adagoltunk. A detektálást másodlagos anti-humán IgG-HRP-vel (1:10 000) végeztük, és tetrametilbenzidin-szubsztrát segítségével fejlesztettük ki, majd 450 nm-en olvastuk le. Pozitív kontrollként SARS-CoV-2 vírussal fertőzött egyének (n = 10) és a vakcina mindkét dózisával immunizált egészséges egyének (n = 20) plazmamintáit használtuk. Negatív kontrollként olyan egészséges embereket használtunk (n = 20), akiknek nem volt SARS-CoV-2 fertőzésük és nem kaptak SARS-CoV-2 elleni védőoltást. Az antites-koncentrációt a standard görbe segítségével számoltuk ki a vonatkozó antitestek ismert koncentrációiból. (Thermo Fisher Scientific).
Az exoszómák karakterizációja Western blot alkalmazásával
Az exoszómák összes fehérjéjét (15 µg) PAGE segítségével elkülönítettük, és a fehérjéket polivinilidén-difluorid membránra vittük át. A Western blotokat a (9) leírtak szerint végeztük. A célfehérje sávintenzitását az ImageJ szoftver segítségével számszerűsítettük, és minden blotot a CD9-cel normalizáltunk.
Az izolált exoszómák transzmissziós elektronmikroszkópos vizsgálata a SARS-CoV-2 tüskefehérje meghatározására
Az exoszómákat immunogolddal és egér anti-SARS-CoV-2 tüske antitestekkel megjelöltük, és a rácsokhoz koronavírus FIPV3-70 antitestet (1:100) adtunk. A rácsokat mostuk és uranil-acetáttal festettük, majd transzmissziós elektronmikroszkóppal (JEOL USA, Peabody, MA) néztük meg (10).
ELISPOT a SARS-CoV-2 tüskefehérje Ag-re adott humán T-sejtválaszok vizsgálatánál
A vérvételre a tájékozott beleegyezés megszerzése után került sor, és a vizsgálatot az IRB jóváhagyta (IRB-szám: PHXB16-0027-10-18). A PBMC-t Ficoll-izopak gradiens elválasztással (ICN Biomedicals, Aurora, OH) elkülönítették és mélyhűtve tartottuk. Később ezeket a PBMC-ket ELISPOT vizsgálathoz a korábbi publikációkban leírtak szerint feldolgoztuk (9, 10).
Egerek immunizálása SARS-CoV-2 Ag-t tartalmazó exoszómákkal
C57BL/6 egereket s.c. immunizáltunk SARS-CoV-2 tüskefehérje szempontjából pozitív vakcinázott emberekből izolált exoszómákkal (a vakcina 2. dózisát követő 14. napon keletkezett exoszómák). Az állatok három csoportját adjuvánsok nélkül immunizáltuk 100 μg-mal az 1., 7. és 21. napon: 1) kontrollcsoport (n = 5), 2) egy egészséges egyedből a vakcinázást követően izolált exoszómák (n = 5), 3) a vakcinázást követően egy második egészséges egyedből izolált exoszómák (n = 5) és 4) SARS-CoV-2 tüskefehérjével immunizált egerek (n = 5). Az állatokat a 30. napon leöltük, a vérüket összegyűjtöttük az ELISA vizsgálathoz, a lépeket pedig a T-sejtes reakciókhoz gyűjtöttük össze.
SARS-CoV-2 tüskefehérje specifikus antitestek észlelése egerek szérumában
A SARS-CoV-2 tüske antigén elleni antitestek képződését ELISA segítségével állapítottuk meg, az előző szakaszban leírtak szerint.
ELISPOT az egér lépsejtek SARS-CoV-2 tüskefehérje antitestekr eadott válaszainak kimutatásához
Az egerek lépét a vakcinázást követő 30. napon gyűjtöttük be, és a lépsejteket Ficoll-Hypaque gradiens centrifugálással izoláltuk, majd ELISPOT-analízissel vizsgáltuk a korábban leírtak szerint (9, 10).
Statisztikai elemzés
Az adatokat a Prism 8.0 szoftver (GraphPad) segítségével elemeztük. Az exoszómákban lévő antitestek szintjét, valamint az exoszómákban lévő SARS-CoV-2 tüskefehérjét és OD-értékét Wilcoxon rangsor teszt segítségével hasonlítottuk össze. Az állatkísérletek eredményeit kétirányú ANOVA segítségével elemeztük. Az adatokat átlagban és SD-ben fejeztük ki. A <0,05 p értékeket statisztikailag szignifikánsnak tekintettük.
Eredmények és értekezés
Exoszóma izolálás
A vizsgálatunkban használt részecskék átlagos mérete <200 nm volt, ami összhangban van a Nemzetközi Extracelluláris Vezikulák Társasága által leírt exoszóma mérettel. Az exoszómák reprezentatív képeit az (1A. ábra tartalmazza. Az exoszómák számában nem volt számottevő különbség a különböző egyének esetében.
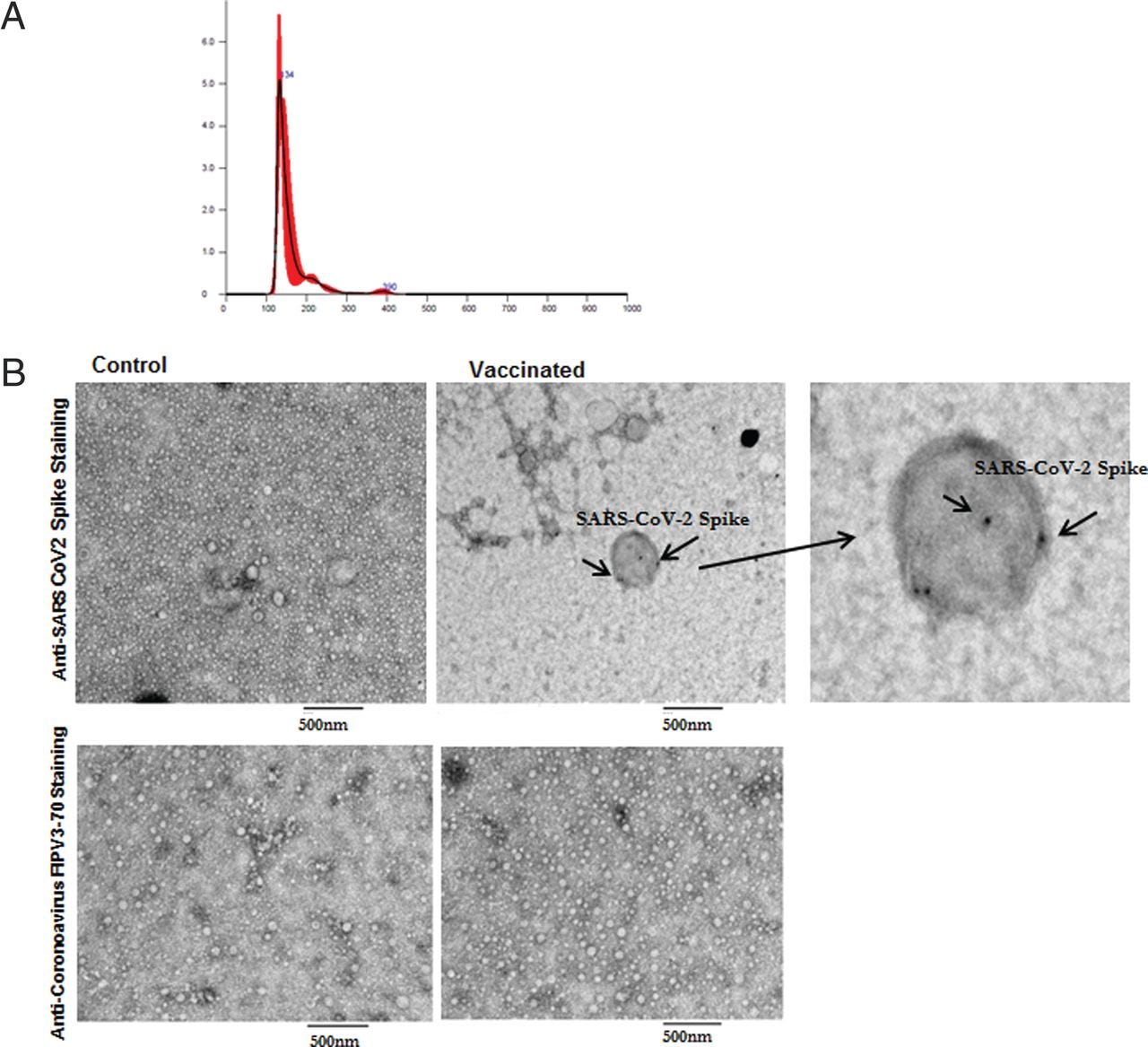
A transzmissziós elektronmikroszkópia a SARS-CoV-2 tüskefehérje felszíni expresszióját mutatta a vakcinázott egyénekből izolált exoszómákban
Transzmissziós elektronmikroszkópos vizsgálatot végeztünk a SARS-CoV-2 tüskéjére specifikus Abs-ek alkalmazásával, hogy igazolni tudjuk a SARS-CoV-2 Ags jelenlétét a kontroll és egészséges vakcinázott egyének exoszómáinak felszínén. A vakcinázott egyének exoszómái pozitívak SARS-CoV-2 Ag-re (1B. ábra). Mindkét exoszómamintát negatív kontrollként koronavírus FIPV3-70 Ab-val is megfestettük, és nem tapasztaltunk pozitív reakciót az exoszómákban (1B. ábra).
A SARS-CoV-2 tüskésfehérje elleni antitestek kialakulásának kinetikája a beoltott emberekben
A SARS-CoV-2 tüskésfehérjére kimutatott antitestek a vakcina második adagjának 14. napja után minden egészséges vakcinázott egyénnél kimutathatók voltak (átlagos koncentráció 2401,25 ± 773,45 ng/ml), p-értékek <0,0001, összehasonlítva a vakcinázás nélküli vakcinázással és az első adag 14. napjával. Az antitestek szintje a vakcinázás után 4 hónappal 1107,38 ± 681,63 ng/ml-re csökkent. Ez a csökkenés szignifikánsan alacsonyabb a második oltás beadását követő 14. napon kialakult antitest értékeknél. (p = 0,0313) (2A ábra).
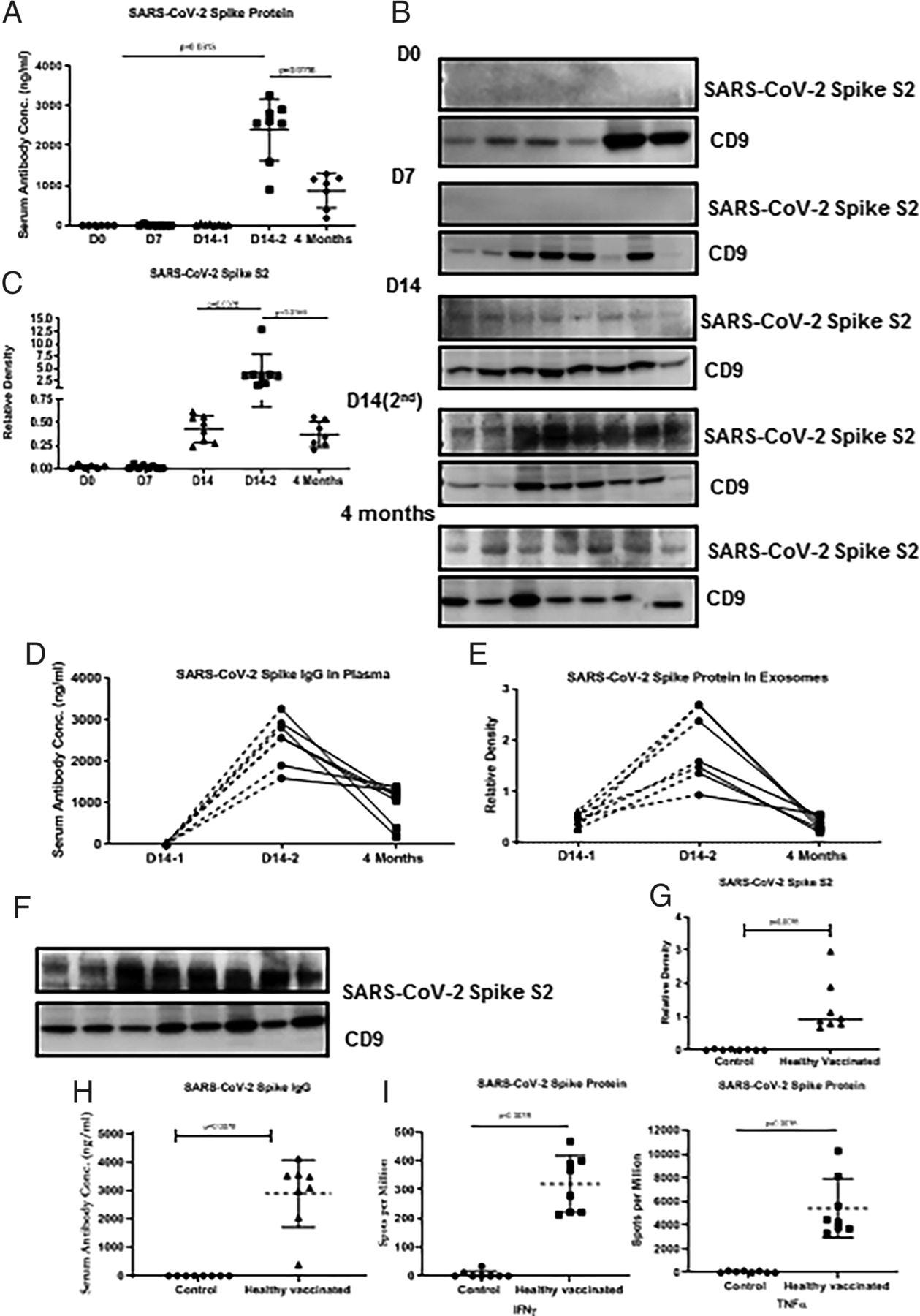
A vakcinázott egyénekből izolált keringő exoszómák SARS-CoV-2 tüskefehérjét Ag S2-t tartalmaznak
A vakcinázott egészséges egyének plazmáját az első vakcinaadagot követő 0., 7. és 14. napon, valamint a második adagot követő 14. napon elemeztük a SARS-CoV-2 tüskefehérjét hordozó exoszómák jelenlétére vonatkozóan (2B, 2C ábra). Az eredmények kimutatták a SARS-CoV-2 tüske Ag S2 jelenlétét az exoszómákon az 1. dózis 14. napján. A 2. dózis 14. napján a tüskefehérje koncentrációja szignifikánsan megemelkedett, a p-érték 0,0299 volt. A SARS-CoV-2 tüskefehérje mennyisége az exoszómákban mindkét vakcinaadag után 4 hónap elteltével szignifikánsan csökkent a második adagot követő 14. naphoz képest, a p-érték 0,0078 volt. A tüskefehérje elleni Ab-fejlődés kinetikája és a tüskefehérjét tartalmazó exoszómák kinetikája minden egyes egészséges egyén esetében különböző időpontokban (14. nap az első és második dózis után és 4 hónap a második dózis után) a (2D. ábra). Az Ab kialakulásának a kinetikája, és a SARS-CoV-2 tüskefehérje-exoszómák mennyisége összhangban van egymással, mivel mindkettő a második emlékeztető dózist követően, a 14. napon megnövekedett (2E ábra). A SARS-CoV-2 tüskefehérje elleni Ab-szint és a SARS-CoV-2 tüskefehérje mennyisége az exoszómákban minden egészséges egyénben csökkent a második emlékeztető adag 14. napjától a második emlékeztető adagot követő 4 hónapig (2D, 2E ábra). Az egyes egyedekre vonatkozó adatokat erre az alcsoportra vonatkozóan a Kiegészítő 1. ábra és a Kiegészítő 2. ábra tartalmazza.
A vakcinázott egészséges egyénekből izolált keringő exoszómák SARS-CoV-2 a tüskefehérje Ag S2-t tartalmaztak
A vakcinázott egészséges egyének exoszómáit a második vakcinaadagot követő 14. napon elemeztük. Az eredmények a SARS-CoV-2 tüskefehérjét tartalmazó exoszómák koncentrációjának jelentős növekedését mutatták (2F, 2G ábra). Ezzel párhuzamosan a SARS-CoV-2 tüskefehérje Abs-szintjének szignifikánsan megnövekedett szintjét is találtuk a két vakcinaadagot követő egyénekben az egészséges kontrollokhoz képest (2H ábra).
Magasabb IFN-γ és TNF-α citokinszintek az egészséges vakcinázott egyénekben a kontrollokhoz képest
A SARS-CoV-2 tüskefehérje Ag-ra adott T-sejtes válaszokat egészséges vakcinázott egyénekben ELISPOT segítségével elemeztük. Az IFN-γ és TNF-α citokineket termelő sejtek száma a SARS-CoV-2 tüske Ag-re adott válaszként szignifikánsan magasabb volt a vakcinázott egészséges egyéneknél, mint az egészséges kontrolloknál (p = 0,0078) (2I. ábra). A citokinek bármelyikét termelő T-sejtek száma a nukleokapszid Ag-re adott válaszban nem volt megnövekedett.
A vakcinált egyénből származó exoszómákkal való immunizálás a SARS-CoV-2 tüskefehérje elleni magasabb Abs-szintet indukált egerekben
C57BL/6 egereket immunizáltunk teljesen vakcinázott egyénekből és kontrollokból izolált exoszómákkal. A teljesen vakcinázott egyénekből származó exoszómákkal immunizált egerek azonban lényegesen magasabb Abs értékeket fejlesztettek a SARS-CoV-2 tüske Ag-ra a 15. napon, mint a kontrollok (181,49 ± 37,02 versus 64,44 ± 1,7; p < 0,0449), a 21. napon (352,82 ± 128,82 versus 20,84 ± 2,24; p < 0,0001) és a 30. napon (372,34 ± 56,08 versus 25,17 ± 1,08 p < 0,0001) (3A ábra). A SARS-CoV-2 tüskefehérjével immunizált C57BL/6 állatok szintén megnövekedett SARS-CoV-2 tüske Ab-szintet mutattak (3A ábra).
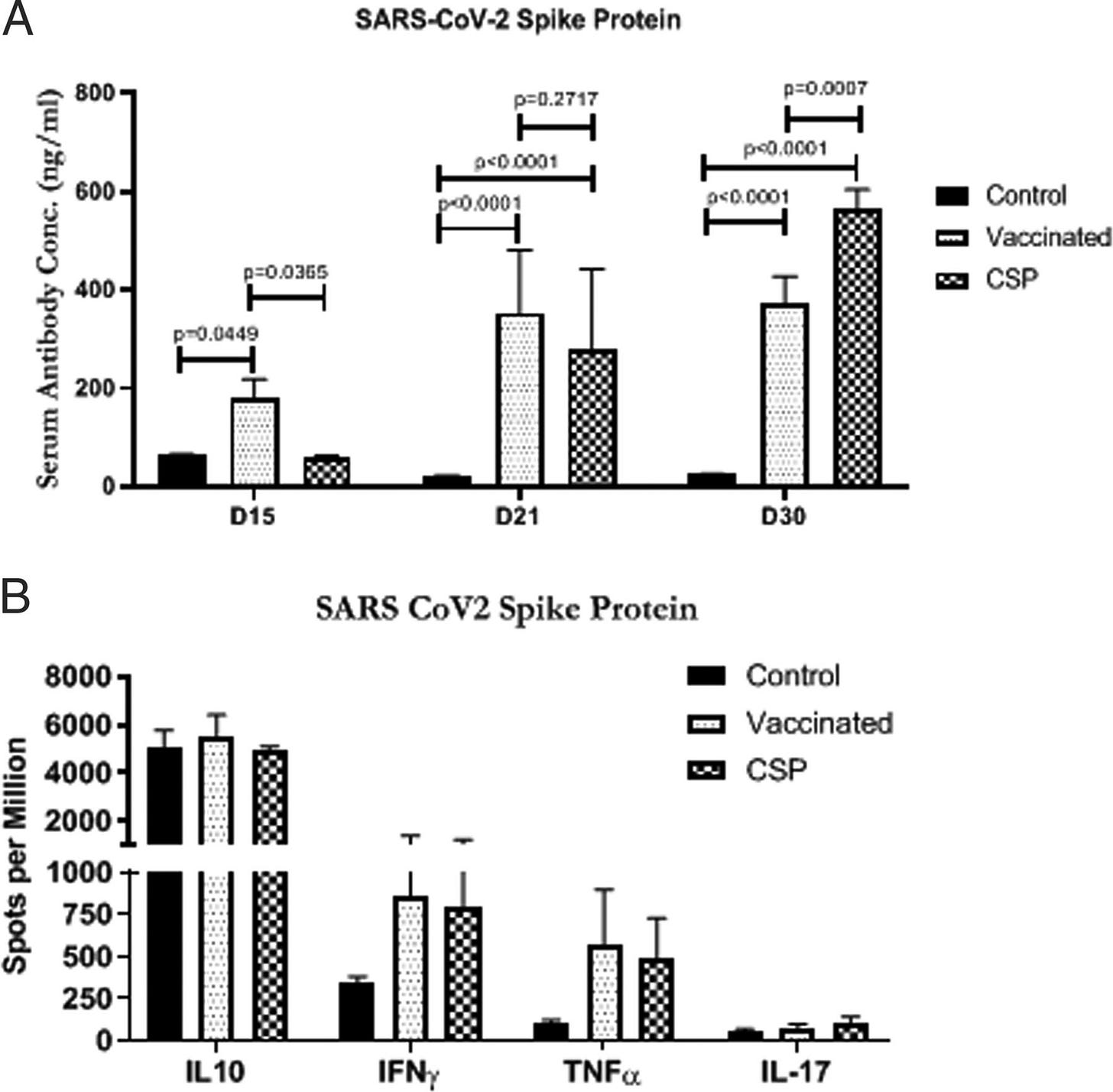
Megemelkedett citokinszintek (IFN-γ és TNF-α) a vakcinázott egyénekből származó exoszómákkal immunizált egerek lépi limfocitáiban
A vakcinázott egyénekből származó exoszómákkal immunizált egerek lépében lévő limfociták a kontrollcsoporttal szemben a citokin-szekretáló sejtek számának növekedését mutatták: IFN-γ (853,77 ± 517,84 versus 340,36 ± 38,78) és TNF-α (568,25 ± 327,72 versus 102,14 ± 19,06) pöttyök egymillióra vetítve, de a különbségek statisztikailag nem szignifikánsak. Hasonló eredményeket figyeltünk meg a SARS-CoV-2 tüskefehérjével immunizált egereknél is (3B. ábra). A SARS-CoV-2 tüskefehérjével immunizált egerek csoportja szintén megnövekedett IFN-γ és TNF-α szintet mutatott (3B. ábra). A jelenlegi vizsgálatban az egyéneknek a Pfizer-BioNTech által kifejlesztett mRNS-alapú vakcinát adtak be, és eredményeink egyértelműen bizonyítják, hogy a vakcina első adagjának beadását követő 14. napig a SARS-CoV-2 tüskefehérjét hordozó exoszómák indukálódtak, majd a booster immunizálást követő 14. napra kialakult a tüskefehérje-specifikus Ab-válasz. Négy hónappal az oltás után az Ab-szintek csökkentek a plazmában. Ugyanez a tendencia volt megfigyelhető a tüskefehérjét tartalmazó keringő exoszómák esetében is. Ezek az eredmények alátámasztják azt a következtetést, miszerint az mRNS-alapú vakcina beadásának eredményeként a keringő exoszómák SARS-CoV-2 tüskefehérjével történő indukciója potenciálisan elkerülhetetlen a hatékony immunizációhoz. Feltételezzük, hogy ezeket a SARS-CoV-2 tüskefehérjét tartalmazó exoszómákat az APC-k felveszik, ami immunaktivációt eredményez. Az exoszómák immunogén potenciáljáról légúti vírusfertőzésekben már beszámoltunk mi is és mások is (11, 12, 13).
C57BL/6 állatokat is immunizáltunk vakcinázott egyénekből izolált, tüskefehérjét hordozó keringő exoszómákkal, és kimutattuk, hogy ezek az exoszómák immunogének. Az immunizálást követően ezek az állatok mind a SARS-CoV-2 tüskefehérjére, mind a SARS-CoV-2 tüskefehérjére specifikus sejtes immunválaszokat fejlesztettek ki. Korábbi eredményeink azt mutatták, hogy egerek immunizálása tüdő-önantigéneket hordozó humán exoszómákkal a tüdő-önantigénekkel szembeni Abs-eket váltott ki. Ez a humán exoszómák egerek APC-jeihez való kötődését követően következett be, ami az egerekben immunválaszt eredményezett. Következésképpen feltételezzük, hogy a mechanizmus, amelynek révén az egerek immunizálását követően immunválaszok alakultak ki, feltételezi az exoszómák kötődését az egerek APC-jeihez, ezáltal létrehozva a tüskefehérje elleni humorális és a sejtes immunválaszt. Az is érdekes, hogy az ilyen immunizációs stratégiával az antigénstimulációt követően megnövekedett az IFN-γ és TNF-α szekréciót termelő lépi limfociták gyakorisága. Az egérmodellekben kapott eredmények alapján azt a feltételezést fogalmazzuk meg, hogy az egészséges egyének mRNS-alapú vakcinázása nemcsak Ab-válaszokat, hanem celluláris immunitást is eredményez. Összefoglalva, a SARS-CoV-2 tüskefehérjét hordozó exoszómák indukálódnak és kimutathatók az első oltási dózist követő 14. napon, és a SARS-CoV-2 tüskefehérjére specifikus Abs-ek később, az emlékeztető dózist követően voltak kimutathatók. Úgy véljük, hogy a keringő exoszómák SARS-CoV-2 tüskefehérje Ag-val történő indukciója szükséges az egészséges egyének mRNS-alapú vakcinázását követő hatékony immunizációhoz. Azt is kimutattuk, hogy a beoltott egyénekből származó exoszómák immunogének voltak, és a SARS-CoV-2 tüskefehérjével szembeni Abs-eket, valamint a tüskefehérje Ag-ra adott T-sejtválaszokat indukáltak, ami arra utal, hogy az mRNS-alapú vakcinázással indukált exoszómák SARS-CoV-2 tüskefehérje Ag-val nem csak humorális immunitást, hanem sejtes immunválaszt is kiváltanak.
(Megjegyzés: ezzel itt a végén neves szakértők nem rértenek egyet, majd feliratozom azt a videót is, a következtetés nem helyes, a cikk ténymegállapításai rendben vannak, a levont következtetések nincsenek rendben)














Share this post